Đề bài
Câu 1. Cho sơ đồ biến hóa: \(Al \to X \to Y \to Z \to Al\)
X, Y, Z lần lượt là?
\(\begin{array}{l}A.\,A{l_2}{(S{O_4})_3},AlC{l_3},Al{(OH)_3}\\B.\,Al{(N{O_3})_3},A{l_2}{O_3},NaAl{O_2}\\C.\,AlC{l_3},Al{(OH)_2},A{l_2}{O_3}.\\D.\,Al{(N{O_3})_3},AlC{l_3},A{l_2}{O_3}.\end{array}\)
Câu 2. Kim loại nào không tan hoàn toàn trong dung dịch HCl dư ở nhiệt độ thường nhưng có thể tan hoàn toàn nếu đun nóng?
A. Cr.
B. Cu.
C. Ni.
D. Pb.
Câu 3.Trong các cặp chất cho dưới đây, cặp chất nào có thể cùng tồn tại trong cùng một dung dịch?
\(\begin{array}{l}A.\,MgC{l_2};\,CuS{O_4}.\\C.\,NaAl{(OH)_4};\,AlC{l_3}.\end{array}\)
\(\begin{array}{l}B.\,NaHS{O_4};\,NaHC{O_3}.\\D.\,NaCl;\,AgN{O_3}.\end{array}\)
Câu 4. Một kim loại X dư hòa tan trong \({H_2}S{O_4}\) loãng thu được 1 chất khí. Nếu thêm \(HN{O_3}\) loãng, dư vào kim loại tiếp tục tan ra tạo thành dung dịch và không thu được khí. Thêm tiếp NaOH dư vào dung dịch thấy có khí mùi khai bay ra và có kết tủa sau đó kết tủa tan hoàn toàn. Kim loại X là?
A. Pb.
B. Al.
C. Sn.
D. Fe.
Câu 5. Trong khi ghi chép kết quả phân tích một dung dịch, có ghi thừa một ion. Đó là ion nào? Biết các ion được ghi là \({K^ + };F{e^{3 + }};C{l^ - };NO_3^ - ;F{e^{2 + }};A{g^ + }.\)
\(A.\,C{l^ - }\)
\(B.\,F{e^{2 + }}\)
\(C.\,\,A{g^ + }\)
\(D.A{g^ + }\) hoặc \(C{l^ - }\) .
Câu 6. Để điều chế \(Al{(OH)_3}\) trong phòng thí nghiệm, nên dùng cách nào là hiệu quả nhất?
A. Đổ từ từ dung dịch NaOH vào dung dịch \(AlC{l_3}\) cho tới dư.
B. Đổ từ dung dịch \(NaAl{O_2}\) vào dung dịch NaOH cho tới dư.
C. Nhỏ dung dịch HCl tới dư vào dung dịch \(NaAl{O_2}\).
D. Rót từ từ dung dịch \(N{H_3}\) vào dung dịch \(AlC{l_3}\) tới dư.
II. PHẦN TỰ LUẬN
Câu 1. (3 điểm)
a) Nung nóng hỗn hợp bột gồm Al và \(C{r_2}{O_3}\) (vừa đủ) trong điều kiện không có không khí. Nghiền nhỏ chất rắn sau phản ứng rồi hòa tan hoàn toàn trong axit HCl loãng nóng. Dung dịch sau phản ứng tác dụng tiếp với khí \(C{l_2}\). Viết các phương trình phản ứng xảy ra
b) Viết công thức phân tử của phèn chua và giải thích tại sao phèn chua có thể làm trong nước.
Câu 2. (4 điểm)
Cho 10,5 gam hỗn hợp 2 kim loại gồm Al và một kim loại kiềm M vào trong nước. Sau phản ứng chỉ thu được dung dịch B và 5,6 lít khi (đktc). Cho từ từ dung dịch HCl 0,1M vào dung dịch B để thu được một lượng kết tủa lớn nhất. Lọc và cân kết tủa được
7,8 gam.
a) Tìm kim loại kiềm và thể tích dung dịch HCl đã dùng.
b) Tính thể tích dung dịch HCl 0,1 M cần cho vào B để thu được 3,9 gam kết tủa.
Lời giải chi tiết
Câu 1. Chọn C.
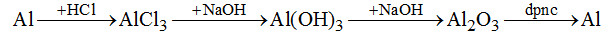
A sai: \(Al{(OH)_3} \to Al\)
B sai: \(NaAl{O_2} \to Al\) (Ba phản ứng không thể thực hiện được)
C sai: \(AlC{l_3} \to A{l_2}{O_3}\)
Câu 2. Chọn D.
Câu 3. Chọn A.
\(\begin{array}{l}NaHS{O_4} + NaHC{O_3} \to N{a_2}S{O_4} + C{O_2} + {H_2}O\\3NaAl{(OH)_4} + AlC{l_3} \to 4Al{(OH)_3} + 3NaCl\\NaCl + AgN{O_3} \to AgCl + NaN{O_3}\end{array}\)
Câu 4. Chọn B.
Câu 5. Chọn C.
Câu 6. Chọn D.
A, C sai: \(Al{(OH)_3}\) mới sinh ra tan trong HCl hoặc NaOH dư
B sai: không phản ứng.
II. PHẦN TỰ LUẬN (7 điểm)
Câu 1. (3 điểm).
\(\begin{array}{l}a)\,Al + C{r_2}{O_3} \to A{l_2}{O_3} + 2Cr\\A{l_2}{O_3} + 6HCl \to 2AlC{l_3} + 3{H_2}O\\Cr + 2HCl \to CrC{l_2} + {H_2}\\2CrC{l_2} + C{l_2} \to CrC{l_3}\end{array}\)
b) Phèn chua: \({K_2}S{O_4}.A{l_2}{(S{O_4})_3}.24{H_2}O\) (hoặc \(KAl{(S{O_4})_2}.12{H_2}O\))
Khi tan trong nước:
\({K_2}S{O_4}.A{l_2}{(S{O_4})_3}.24{H_2}O \to\)\(\, 2{K^ + } + 2A{l^{3 + }} + 4SO_4^{2 - } + 24{H_2}O\)
\(\begin{array}{l}A{l^{3 + }} + {H_2}O\mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} AlO{H^{2 + }} + {H^ + }\\AlO{H^ + } + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} Al{(OH)_2}^ + + {H^ + }\\Al{(OH)_2}^ + + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} Al{(OH)_3} + {H^ + }\end{array}\)
\(Al{(OH)_3}\) là kết tủa keo sẽ kết dính các hạt bẩn lơ lửng (keo đất) làm các hạt này lắng xuống.
Câu 2. (4 điểm).
\(\begin{array}{l}a)\,{n_{{H_2}}} = 0,25mol;\,{n_{Al{{(OH)}_3}}} = 0,1mol\\M + {H_2}O \to MOH + \dfrac{1}{2}{H_2}\\MOH + Al + 3{H_2}O \to M\left[ {Al{{(OH)}_4}} \right] + \dfrac{3}{2}{H_2}\\M\left[ {Al{{(OH)}_4}} \right] + HCl \to Al{(OH)_3} + MCl\\{n_{Al}} = {n_{HCl}} = {n_{Al{{(OH)}_3}}} = 0,1mol\\{n_{{H_2}}} = \dfrac{3}{2}{n_{Al}} + \dfrac{1}{2}{n_M} = 0,25mol \\\to {n_M} = 0,1mol\\{m_{hh}} = 10,5 = {M_M}.0,2 + 27.0,1\\ \Rightarrow {M_M} = 39\left( K \right)\\{V_{HCl}} = \dfrac{{0,1}}{{0,1}} = 1\left( {lit} \right).\end{array}\)
b) TH1: Kết tủa chưa đạt cực đại sau đó tan bớt còn 3,9 gam.
\(\begin{array}{l}M\left[ {Al{{(OH)}_4}} \right] + HCl \to Al{(OH)_3} + MCl\\\,\,\,\,\,\,\,\,\,\,0,05\,\,\,\,\,\,\,\,\,\,\;\;\;\;\;0,05\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,mol\\ \to {V_{HCl}} = \dfrac{{0,05}}{{0,1}} = 0,5\end{array}\)
TH2: Kết tủa đạt cực đại (7,8 gam) sau đó tan bớt còn 3,9 gam.
\(\begin{array}{l}M\left[ {Al{{(OH)}_4}} \right] + HCl \to Al{(OH)_3} + MCl\\\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,1\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,1\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,mol\\Al{(OH)_3} + 3HCl \to AlC{l_3} + 3{H_2}O\\\,\,\,0,05\,\,\,\,\,\,\,\,\,\,\,\,\,0,15\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,mol\\ \to {V_{HCl}} = \dfrac{{(0,15 + 0,1)}}{{0,1}} = 2,5.\end{array}\)
soanvan.me
