Đề bài
Chất A là một ancol có mạch cacbon không phân nhánh. Đốt cháy hoàn toàn m gam A, người ta thu được 2,24 lít CO2 (đktc) và 2,25 g H2O. Mặt khác, nếu cho 18,55 g A tác dụng hết với natri, thu được 5,88 lít H2 (đktc).
1. Hãy xác định công thức phân tử, công thức cấu tạo và tên của chất A.
2. Tính giá trị m.
Phương pháp giải - Xem chi tiết
+) So sánh số mol H2O và CO2 để kết luận đặc điểm của ancol (số mol H2O tạo thành > số mol CO2. Vậy, A phải là ancol no, mạch hở.)
+) Gọi A có dạng: CnH2n+2-x(OH)x hay CnH2n+2Ox
+) Viết PTHH:
\({C_n}{H_{2n + 2}}{O_x} + \dfrac{{3n + 1 - x}}{2}{O_2} \to nC{O_2} + (n + 1){H_2}O\)
\({C_4}{H_{10 - x}}{(OH)_x} + xNa \to {C_4}{H_{10 - x}}{(ONa)_x} + \dfrac{x}{2}{H_2}O\)
+) Dựa theo PTHH, lập phương trình ẩn x, giải pt => CTPT của A.
2. Tính số mol A theo số mol CO2 => m
Lời giải chi tiết
1. Số mol CO2 = \(\dfrac{{2,24}}{{22,4}}\) = 0,1 (mol).
Số mol H2O = \(\dfrac{{2,25}}{{18}}\) =0,125 (mol).
Khi đốt ancol A, số mol H2O tạo thành > số mol CO2. Vậy, A phải là ancol no, mạch hở. A có dạng CnH2n+2-x(OH)x hay CnH2n+2Ox.
\({C_n}{H_{2n + 2}}{O_x} + \dfrac{{3n + 1 - x}}{2}{O_2} \to nC{O_2} + (n + 1){H_2}O\)
Theo đầu bài ta có : \(\dfrac{n}{{n + 1}} = \dfrac{{0,1}}{{0,125}}\) \( \Rightarrow \) n = 4.
\({C_4}{H_{10 - x}}{(OH)_x} + xNa \to {C_4}{H_{10 - x}}{(ONa)_x} + \dfrac{x}{2}{H_2}O\)
Theo phương trình : Cứ (58 + 16x) g A tạo ra 0,5000x mol H2.
Theo đầu bài : Cứ 18,55 g A tạo ra \(\dfrac{{5,88}}{{22,4}}\) = 0,2625 mol H2.
\( \Rightarrow \dfrac{{58 + 16{\rm{x}}}}{{18,55}} = \dfrac{{0,5{\rm{x}}}}{{0,2625}} \Rightarrow x = 3\)
CTPT của A là C4H10O3.
Theo đầu bài A có mạch cacbon không nhánh ; như vậy các CTCT thích hợp là
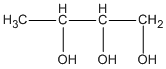 butan-1,2,3 triol
butan-1,2,3 triol
và 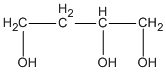 butan-1,2,4-triol.
butan-1,2,4-triol.
2. Để tạo ra 0,1 mol CO2 ; số mol A cần đốt là : \(\dfrac{{0,1}}{4}\) = 0,025 (mol).
Như vậy : m = 0,025.106 = 2,65 (g).
soanvan.me
