Câu 1
Viết phương trình hóa học biểu diễn các phản ứng theo sơ đồ biến hóa sau: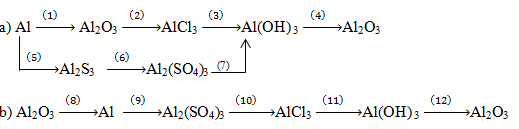
Phương pháp giải:
Xem lại lí thuyết về tính chất hóa học của nhôm Tại đây
Lời giải chi tiết:
(1) \(4Al + 3{O_2}\buildrel {{t^o}} \over\longrightarrow 2A{l_2}{O_3}\)
(2) Al2O3 + 6HCl → 2AlCl3 + 3H2O
(3) AlCl3 + 3NaOH → Al(OH) 3 + NaCl
(4) \(2Al{\left( {OH} \right)_3}\buildrel {{t^0}} \over\longrightarrow A{l_2}{O_3} + 3{H_2}O\)
(5) \(2Al + 3S\buildrel {{t^o}} \over\longrightarrow A{l_2}{S_3}\)
(6) Al2S3 + 3H2SO4 → Al2(SO4)3 + 3H2S
(7) Al2(SO4)3 + 3Ba(OH)2 → 3BaSO4 + 2Al(OH)3
(8) \(2A{l_2}{O_3}\buildrel {{t^o}} \over\longrightarrow 4Al + 3{O_2}\)
(9) 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
(10) Al2(SO4)3 + 3BaCl2→ 3BaSO4 + 2AlCl3
(11) AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
(12) \(2Al{\left( {OH} \right)_3}\buildrel {{t^o}} \over \longrightarrow A{l_2}{O_3} + 3{H_2}O\)
Câu 2
Hòa tan 4, 5 gam hợp kim nhôm – magie trong dung dịch H2SO4 loãng, dư có 5,04 lít khí hidro bay ra (đktc).
a) Viết các phương trình hóa học.
b) Tính thành phần % các kim loại trong hợp kim.
Phương pháp giải:
+) Gọi số mol nhôm và magie lần lượt là x, y (mol)
+) Tính số mol H2
+) Viết phương trình phản ứng
+) Lập và giải hệ phương trình
+) Tính thành phần % các kim loại
Lời giải chi tiết:
a) Các phương trình hóa học:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Mg + H2SO4 → MgSO4 + H2
b) Số mol khí bay ra = 5,04: 22,4 = 0,225 mol
Phương trình hóa học:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Mg + H2SO4 → MgSO4 + H2
Đặt số mol Al = x mol thì số gam Al = 27x gam
số mol Mg = y mol thì số gam Mg = 24y gam
Ta có phương trình (1): 27x + 24y = 4,5 gam
Theo phương trình hóa học: số mol khí bay ra = 1,5x mol và y mol
Ta có phương trình (2): 1,5x + y = 0,225 mol
Giải hệ phương trình cho x = 0,1 mol hay m Al = 2,7 gam
Và y = 0,075 mol hay mMg = 1,8 gam
% m Al = (2,7: 4,5).100%= 60%
% m Mg = (1,8: 4,5).100%= 40%
soanvan.me
