Câu hỏi 1 :
Hòa tan hoàn toàn Fe3O4 trong dung dịch H2SO4 loãng dư thu được dung dịch X. Dung dịch tác dụng được với chất nào sau đây không xảy ra phản ứng oxi hóa khử:
- A Cu
- B NaOH
- C Cl2
- D KMnO4
Đáp án: B
Phương pháp giải:
Định nghĩa phản ứng oxi hóa – khử: Phản ứng oxi hóa khử xảy ra khi có sự thay đổi số oxi hóa của các nguyên tố.
Lời giải chi tiết:
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
Dung dịch X gồm Fe2+, Fe3+, H+, SO42-.
Phản ứng oxi hóa - khử là phản ứng có sự thay đổi số oxi hóa của các nguyên tố.
Khi NaOH phản ứng với Fe2+, Fe3+ và H+ đều là phản ứng trao đổi (không có sự thay đổi số oxi hóa của các nguyên tố)
Câu hỏi 2 :
Chọn phát biểu đúng trong các phát biểu sau ?
- A Chất oxi hóa là chất nhường electron.
- B Quá trình nhận electron là quá trình oxi hóa.
- C Chất khử là chất nhận electron.
- D Quá trình nhường electron là quá trình oxi hóa.
Đáp án: D
Phương pháp giải:
- Ghi nhớ câu “khử cho – o nhận”
+ Chất khử là chất cho e (bị oxi hóa)
+ Chất oxi hóa là chất nhận e (bị khử)
- Quá trình cho e là quá trình oxi hóa, quá trình nhận e là quá trình khử.
Lời giải chi tiết:
Phát biểu đúng là “quá trình nhường electron là quá trình oxi hóa.”
Câu hỏi 3 :
Dấu hiệu để nhận biết một phản ứng oxi hóa – khử là
- A tạo ra chất khí.
- B tạo ra chất kết tủa.
- C có sự thay đổi màu sắc của các chất.
- D có sự thay đổi số oxi hóa của một số nguyên tố.
Đáp án: D
Lời giải chi tiết:
Phản ứng oxi hóa khử là phản ứng có sự thay đổi số oxi hóa của một hay nhiều nguyên tố.
Câu hỏi 4 :
Cho phản ứng: KMnO4 + FeSO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O
Hệ số của chất oxi hóa và chất khử trong phản ứng trên lần lượt là
- A 5 và 1.
- B 2 và 10.
- C 1 và 5.
- D 5 và 2.
Đáp án: B
Phương pháp giải:
Cân bằng phản ứng oxi hóa khử bằng phương pháp thăng bằng electron.
Chất khử là chất cho e, chất oxi hóa là chất nhận e.
Lời giải chi tiết:
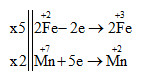
2KMnO4 + 10FeSO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Chất oxi hóa là KMnO4 có hệ số là 2
Chất khử là FeSO4 có hệ số là 10
Câu hỏi 5 :
Trong phản ứng: 4NH3 + 3O2 -> 2N2 + 6H2O. Vai trò của NH3 là
- A chất khử
- B chất khử, đồng thời là chất oxi hóa
- C chất oxi hóa
- D chất cho và nhận electron.
Đáp án: A
Phương pháp giải:
Xác định số oxi hóa của N trước và sau phản ứng từ đó suy ra vai trò của NH3 trong phản ứng.
Lời giải chi tiết:
\(4\mathop N\limits^{ - 3} {H_3} + {\rm{ }}3{O_2} \to 2{\mathop {N_2}\limits^0 } + {\rm{ }}6{H_2}O\)
=>\(2\mathop N\limits^{ - 3} - 6e \to {\mathop {N_2}\limits^0 }\)
NH3 nhường e => NH3 là chất khử
Câu hỏi 6 :
Cho quá trình Fe2+ → Fe3+ + 1e, đây là quá trình
- A tự oxi hóa – khử.
- B nhận proton.
- C oxi hóa.
- D khử .
Đáp án: C
Phương pháp giải:
- Xác định xem Fe2+ → Fe3+ + 1e là quá trình nhường hay nhận e.
- Nếu là quá trình nhường e → quá trình oxi hóa.
Nếu là quá trình nhận e → quá trình khử
Lời giải chi tiết:
Fe2+ → Fe3+ + 1e là quá trình nhường e
→ Đây là quá trình oxi hóa.
Câu hỏi 7 :
Phản ứng nào sau đây là phản ứng oxi hóa-khử?
- A 2HgO → 2Hg + O2.
- B CaCO3 → CaO + CO2.
- C 2Al(OH)3 → Al2O3 + 3H2O.
- D 2NaHCO3 → Na2CO3 + CO2 + H2O.
Đáp án: A
Phương pháp giải:
Phản ứng oxi hóa khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa
Lời giải chi tiết:
Phản ứng oxi hóa khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa
Chỉ có phản ứng 2HgO → 2Hg + O2 có sự thay đổi số oxi hóa
Câu hỏi 8 :
Cho phản ứng: Mg + H2SO4 → MgSO4 + S + H2O. Tổng hệ số cân bằng là:
- A 18
- B 16
- C 20
- D 15
Đáp án: D
Phương pháp giải:
Cân bằng phản ứng oxi hóa – khử bằng phương pháp thăng bằng electron.
Lời giải chi tiết:
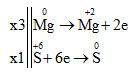
3Mg + 4H2SO4 → 3MgSO4 + S + 4H2O
Tổng hệ số cân bằng là: 3 + 4 + 3 + 1 + 4 = 15
Câu hỏi 9 :
Hệ số của HNO3 trong phản ứng: Zn + HNO3 → Zn(NO3)2 + N2O + N2 + H2O (biết tỉ lệ mol của N2O : N2 = 2 : 3) là
- A
55.
- B
56.
- C
70.
- D
50.
Đáp án: B
Lời giải chi tiết:
$\overset{0}{\mathop{Zn}}\,\text{ }+\text{ }H\overset{+5}{\mathop{N}}\,{{O}_{3}}\to \overset{+2}{\mathop{\text{ }Zn}}\,{{\left( N{{O}_{3}} \right)}_{2}}+\text{ }{{\overset{+1}{\mathop{N}}\,}_{2}}O\text{ }+\text{ }{{\overset{0}{\mathop{N}}\,}_{2}}+\text{ }{{H}_{2}}O$
$\begin{matrix} \text{23x} \\ {} \\ \text{1x} \\\end{matrix}\left| \begin{align} & \overset{0}{\mathop{Zn}}\to \overset{+2}{\mathop{Zn}}+2\text{e} \\ & 10\overset{+5}{\mathop{N}}+46\text{e}\to2{{\overset{+1}{\mathop{N}}}_{2}}O+3{{\overset{0}{\mathop{N}}}_{2}} \\ \end{align} \right.$
+) Vì tỉ lệ mol của N2O : N2 là 2 : 3 => thêm 2 trước N2O và thêm 3 trước N2 sau đó tính tổng e nhận = 10.5 - 2.2.1 - 0 = 46
+) Chọn hệ số sao cho tổng e cho = tổng e nhận => nhân 23 ở quá trình cho e và nhân 1 ở quá trình nhận e
=> cân bằng: 23Zn + 56HNO3 → 23Zn(NO3)2 + 2N2O + 3N2 + 28H2O
Câu hỏi 10 :
Hòa tan hoàn toàn 2,4 gam kim loại Mg vào dung dịch HNO3 loãng chỉ thu được V lít khí N2 (đktc, sản phẩm khử duy nhất). Giá trị của V là
- A
0,672 lít
- B
6,720 lít
- C
0,448 lít
- D
4,48 lít
Đáp án: C
Phương pháp giải:
Bảo toàn electron: $2.{{n}_{Mg}}=10.{{n}_{{{N}_{2}}}}=>{{n}_{{{N}_{2}}}}$
Lời giải chi tiết:
nMg = 0,1 mol
Bảo toàn electron: $2.{{n}_{Mg}}=10.{{n}_{{{N}_{2}}}}=>{{n}_{{{N}_{2}}}}=\frac{{{n}_{Mg}}}{5}=0,02\,\,mol$
=> V = 0,02.22,4 = 0,448 lít
