Câu hỏi 1 :
Ion Y2+ có cấu hình electron: 1s22s22p63s23p6. Vị trí của Y trong bảng tuần hoàn là
- A chu kì 4, nhóm IA.
- B chu kì 3, nhóm IIA.
- C chu kì 4, nhóm IIA.
- D chu kì 3, nhóm VIA.
Đáp án: C
Phương pháp giải:
1. Từ cấu hình e của ion ta suy ra cấu hình e của nguyên tử
2. Từ cấu hình e nguyên tử suy ra vị trí của nguyên tố trong bảng tuần hoàn:
+ Số lớp e = số thứ tự chu kì
+ Số e lớp ngoài cùng = số thứ tự nhóm (đối với nhóm A)
Lời giải chi tiết:
Y2+ có cấu hình electron: 1s22s22p63s23p6 => Cấu hình e của Y: 1s22s22p63s23p64s2
=> Y ở chu kì 4, nhóm IIA
Câu hỏi 2 :
Các nguyên tố hóa học trong cùng một nhóm A có đặc điểm nào chung về cấu hình electron nguyên tử?
- A
Số electron hóa trị.
- B
Số lớp electron.
- C
Số electron lớp K.
- D
Số phân lớp electron.
Đáp án: A
Lời giải chi tiết:
Các nguyên tố hóa học trong cùng một nhóm A có đặc điểm chung là có số electron hóa trị.
Câu hỏi 3 :
Tổng số elecron trong ion NO3- là (Cho: 7N, 8O):
- A 32
- B 3
- C 31
- D 24
Đáp án: A
Lời giải chi tiết:
Số e của ion NO3- là: 7 + 3.8 + 1 = 32
Câu hỏi 4 :
Nguyên tử của nguyên tố R có cấu hình electron 1s22s22p3, công thức hợp chất khí với hidro và công thức oxit cao nhất là
- A RH2, RO
- B RH3, R2O5
- C RH5, R2O3
- D RH4, RO2
Đáp án: B
Phương pháp giải:
Tổng hóa trị của một nguyên tố trong oxit cao nhất và trong hợp chất khí với H bằng 8
Lời giải chi tiết:
R có cấu hình electron 1s22s22p3 => R có 5e ở lớp ngoài cùng => R ở nhóm VA
=> Oxit cao nhất: R2O5
=> Hợp chất khí với H: RH3
Câu hỏi 5 :
Những electron có năng lượng gần bằng nhau được xếp vào cùng một… Hãy chọn từ thích hợp điền vào chỗ trống.
- A nhóm
- B lớp
- C phân lớp
- D chu kì
Đáp án: B
Phương pháp giải:
Dựa vào kiến thức sắp xếp vào cùng lớp, phân lớp, nhóm, chu kì
Lời giải chi tiết:
Những electron có năng lượng gần bằng nhau được xếp vào cùng một lớp.
Câu hỏi 6 :
Oxit cao nhất của một nguyên tố R ứng với công thức RO2. Nguyên tố R đó là:
- A Magie
- B Cacbon
- C Nitơ
- D Photpho
Đáp án: B
Phương pháp giải:
Hóa trị của một nguyên tố nhóm A trong oxit cao nhất bằng số thứ tự nhóm của nguyên tố đó.
Lời giải chi tiết:
Trong RO2, R có hóa trị IV => R thuộc nhóm IVA => Cacbon
Câu hỏi 7 :
Nguyên tố R có công thức oxit cao nhất là RO3. Công thức hợp chất khí với hidro là:
- A RH4
- B RH3
- C RH2
- D RH
Đáp án: C
Phương pháp giải:
Tổng hóa trị của một nguyên tố trong hợp chất với H và trong oxi cao nhất có giá trị bằng 8.
Lời giải chi tiết:
Trong oxit cao nhất RO3 thì R có hóa trị VI nên trong hợp chất khí với H, R có hóa trị II.
=> RH2
Câu hỏi 8 :
Nguyên tử nguyên tố X có tổng số hạt electron trong các phân lớp p là 7. Số hạt mang điện của một nguyên tử Y nhiều hơn số hạt mang điện của một nguyên tử X là 8 hạt. Xác định tên các nguyên tố X và Y (biết số hiệu nguyên tử của nguyên tố: Na = 11, Al =13, P= 15, Cl=17, Fe= 26)
- A Fe và Cl
- B Na và Cl
- C Al và Cl
- D Al và P
Đáp án: C
Phương pháp giải:
Từ đề bài viết cấu hình electron nguyên tử của X, từ đó xác định được số e của X và tên nguyên tố X.
Từ số e, số p của X suy ra số hiệu nguyên tử của Y, từ đó xác định được tên nguyên tố Y.
Lời giải chi tiết:
Nguyên tử nguyên tố X có tổng số hạt electron trong các phân lớp p là 7.
Vậy cấu hình electron của X là 1s22s22p63s23p1
Số electron của X bằng 13. Suy ra số hạt mang điện của X bằng 2.13= 26
Số hạt mang điện của Y bằng 26 + 8 =34 hạt → Y có số hiệu nguyên tử Z = 34 : 2 = 17
Vậy X, Y lần lượt là Al và Cl
Câu hỏi 9 :
Nguyên tử Na, Mg, F lần lượt có số hiệu nguyên tử là 11, 12, 9. Các ion Na+, Mg2+, F- khác nhau về
- A số electron lớp ngoài cùng.
- B số electron.
- C số lớp electron.
- D số proton.
Đáp án: D
Lời giải chi tiết:
Những ion thuộc những nguyên tố khác nhau thì có số p khác nhau
Câu hỏi 10 :
Nói về cấu tạo lớp vỏ electron của nguyên tử, phát biểu nào sau đây sai?
- A Lớp thứ hai chứa tối đa 8 electron.
- B Phân lớp d chứa tối đa 5 electron.
- C Phân lớp p chứa tối đa 6 electron.
- D Lớp thứ ba chứa tối đa 18 electron.
Đáp án: B
Phương pháp giải:
Dựa vào quy tắc số electron tối đa trong phân lớp và lớp electron:
+ Lớp thứ n có tối đa 2n2 electron.
+ Phân lớp s có tối đa 2 electron, phân lớp p có tối đa 6 electron, phân lớp d có tối đa 10 electron, phân lớp f có tối đa 14 electron.
Lời giải chi tiết:
Dựa vào quy tắc số electron tối đa trong phân lớp và lớp electron:
+ Lớp thứ n có tối đa 2n2 electron.
+ Phân lớp s có tối đa 2 electron, phân lớp p có tối đa 6 electron, phân lớp d có tối đa 10 electron, phân lớp f có tối đa 14 electron.
- Xét A: Lớp thứ hai có chứa tối đa 2.22 = 8 electron → Phát biểu A đúng.
- Xét B: Phân lớp p có tối đa 6 electron → Phát biểu C đúng.
- Xét C: Phân lớp d chứa tối đa 10 electron →Phát biểu B sai.
- Xét D: Lớp thứ ba có chứa tối đa 2.32 = 18 electron → Phát biểu D đúng.
Câu hỏi 11 :
Trong các câu sau đây, câu nào sai ?
- A
Electron là hạt mang điện tích âm.
- B
Electron có khối lượng 9,1094.10-28 gam.
- C
Electron chỉ thoát ra khỏi nguyên tử trong những điều kiện đặc biệt.
- D
Electron có khối lượng đáng kể so với khối lượng nguyên tử.
Đáp án: D
Lời giải chi tiết:
Câu sai là: Electron có khối lượng đáng kể so với khối lượng nguyên tử.
Vì electron có khối lượng rất nhỏ bé so với proton và nơtron
Câu hỏi 12 :
Biết cấu hình electron của nguyên tử nguyên tố có thể xác định được các yếu tố nào sau đây?
1. Vị trí của nguyên tố trong bảng tuần hoàn (STT; chu kì; nhóm).
2. Tính chất hóa học của nguyên tố.
3. Công thức oxit cao nhất và hiđroxit tương ứng.
4. So sánh tính chất hóa học với các nguyên tố khác.
5. Tính khối lượng nguyên tử trung bình của nguyên tố.
6. Tính số p, n.
- A
1, 2, 4, 5.
- B
1, 2, 3, 4.
- C
1, 2, 5, 6.
- D
1, 2, 3, 6
Đáp án: B
Phương pháp giải:
Xem lại lí thuyết bài sự biến đổi tính chất của các nguyên tố hóa học
Lời giải chi tiết:
Biết cấu hình electron của nguyên tử nguyên tố có thể xác định được
1. Vị trí của nguyên tố trong bảng tuần hoàn (STT; chu kì; nhóm).
2. Tính chất hóa học của nguyên tố.
3. Công thức oxit cao nhất và hiđroxit tương ứng.
4. So sánh tính chất hóa học với các nguyên tố khác.
Câu hỏi 13 :
Phát biểu nào sau đây không đúng?
- A Nguyên tố cacbon chỉ gồm những nguyên tử có cùng số đơn vị điện tích hạt nhân là 6.
- B Các đồng vị của một nguyên tố hóa học có tính chất vật lí và tính chất hóa học đều giống nhau
- C Số đơn vị điện tích hạt nhân và số khối là những đặc trưng cơ bản của nguyên tử
- D Một nguyên tử có số hiệu là 29 và có số khối là 61 thì nguyên tử đó phải có 29 electron
Đáp án: B
Phương pháp giải:
Dựa vào định nghĩa nguyên tố hóa học, định nghĩa đồng vị để tìm phát biểu không đúng.
Lời giải chi tiết:
Phát biểu A đúng vì nguyên tố hóa học là các nguyên tử có cùng điện tích hạt nhân. Cacbon có Z=6 nên có 6 proton tức là điện tích hạt nhân là +6, số đơn vị điện tích hạt nhân là 6.
Phát biểu B sai vì các đồng vị của cùng 1 nguyên tố hóa học có số n trong hạt nhân khác nhau nên có 1 số tính chất vật lí khác nhau.
Phát biểu C đúng.
Phát biểu D đúng vì nguyên tử có số hiệu nguyên tử là 29 tức là có số p= số e = 29.
Câu hỏi 14 :
Vi hạt nào sau đây có số electron nhiều hơn số nơtron?
- A Ion natri (\({}_{11}^{23}N{a^ + }\))
- B Ion kali (\({}_{19}^{39}K^+\))
- C Ion clorua (\({}_{17}^{35}C{l^ - }\))
- D Ion sunfua (\({}_{16}^{32}S^{2-}\))
Đáp án: D
Phương pháp giải:
Xác định số e và số p của từng vi hạt và so sánh.
Lời giải chi tiết:
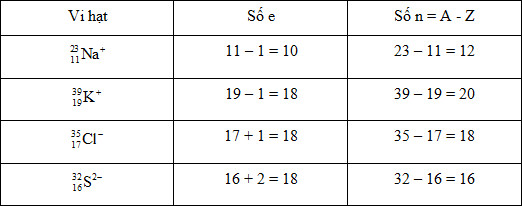
Câu hỏi 15 :
Cho các nhận xét sau: Trong nguyên tử:
(1) Tổng số hạt proton bằng điện tích hạt nhân nguyên tử.
(2) Số hạt proton trong hạt nhân luôn bằng số electron lớp vỏ của nguyên tử.
(3) Số hạt proton bằng số hạt nơtron.
(4) Số hạt nơtron trong hạt nhân luôn bằng số electron ở lớp vỏ của nguyên tử.
Số nhận xét không đúng là:
- A 2
- B 3
- C 1
- D 4
Đáp án: B
Phương pháp giải:
Dựa vào đặc điểm về điện tích và khối lượng của các loại hạt proton, nơtron và electron để tìm nhận xét đúng.
Lời giải chi tiết:
Nhận xét (1) không đúng vì tổng số hạt proton bằng số đơn vị điện tích hạt nhân nguyên tử.
Nhận xét (2) đúng.
Nhận xét (3) không đúng vì trong hạt nhân số hạt proton và số hạt nơtron có thể bằng nhau hoặc không bằng nhau.
Nhận xét (4) không đúng vì số hạt notron trong hạt nhân không nhất thiết phải bằng số electron ở lớp vỏ của nguyên tử.
Vậy có 3 nhận xét không đúng.
Câu hỏi 16 :
Cho các nhận định sau về cấu hình electron:
(1) Các electron được điền từ phân lớp có mức năng lượng cao tới phân lớp có mức năng lượng thấp.
(2) Các electron tối đa trong phân lớp s và p lần lượt là 1 và 3.
(3) Các electron được sắp xếp vào các obitan sao cho số electron độc thân là lớn nhất.
(4) Các electron trong cùng một obitan cùng quay theo một trục và một chiều xác định.
Số nhận định chính xác là:
- A
1
- B
2
- C
3
- D
4
Đáp án: A
Lời giải chi tiết:
Nhận định đúng là:
(3) Các electron được sắp xếp vào các obitan sao cho số electron độc thân là lớn nhất.
(1) sai. Các electron được điền từ phân lớp có mức năng lượng thấp tới cao
(2) sai. Các electron tối đa trong phân lớp s và p lần lượt là 2 và 6.
(4) sai. Các electron trong cùng một obitan quay theo 2 chiều ngược nhau.
Câu hỏi 17 :
Nguyên tử kẽm có bán kính r = 1,35.10-1 nm và có khối lượng nguyên tử là 65u. Khối lượng riêng của kẽm là
- A
11,26 \(g/cm^3 \)
- B
10,48 \( g/cm^3\)
- C
9,46 \(g/cm^3 \)
- D
12,28 \(g/cm^3 \)
Đáp án: B
Phương pháp giải:
RZn = 1,35.10-1 nm = 0,135.10-7 cm
Vnguyên tử Zn = \(\dfrac{4}{3}.\pi .{R^3} = \dfrac{4}{3}.\pi .(0,{135.10^{ - 7}})\)
Dnguyên tử Zn = \(\dfrac{m}{V}\)
Lời giải chi tiết:
RZn = 1,35.10-1 nm = 0,135.10-7 cm (1 nm = 10-9 m)
1u = 1,6605.10-24 gam
mZn = 65.1,6605.10-24 = 107,9.10-24 gam
Vnguyên tử Zn = $\dfrac{4}{3}.\pi .{{R}^{3}}=\\\dfrac{4}{3}.\pi .{{(0,{{135.10}^{-7}})}^{3}}=\\10,{{3.10}^{-24}}\,\,c{{m}^{3}}$
Dnguyên tử Zn = \(\dfrac{m}{V} = \dfrac{{107,{{9.10}^{ - 24}}}}{{10,{{3.10}^{ - 24}}}} = 10,48\,\,g/c{m^3}\)
Câu hỏi 18 :
Trong tự nhiên brom có hai đồng vị là \({}_{35}^{79}{\text{Br}}\) và \({}_{35}^{81}{\text{Br}}\), nguyên tử khối trung bình của brom là 79,986. Nếu nguyên tử khối mỗi đồng vị có giá trị bằng số khối thì tỉ lệ % số nguyên tử đồng vị \({}_{35}^{79}{\text{Br}}\) là
- A 49,3%.
- B 50,7%.
- C 46%.
- D 54%.
Đáp án: B
Phương pháp giải:
Dựa vào công thức tính số khối trung bình.
Lời giải chi tiết:
Gọi phần trăm số nguyên tử của là x % và là y%
Ta có hệ phương trình:
\(\left\{ \begin{gathered}
x + y = 100 \hfill \\
\dfrac{{79x + 81y}}{{100}} = 79,986 \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
x = 50,7\% \hfill \\
y = 49,3\% \hfill \\
\end{gathered} \right.\)
Câu hỏi 19 :
Nguyên tử khối trung bình của Cu là 63,546. Đồng tồn tại trong tự nhiên với 2 loại đồng vị là \({}_{29}^{65}Cu\) và \({}_{29}^{63}Cu\). Thành phần phần trăm về nguyên tử của \({}_{29}^{63}Cu\) là:
- A 72,7%
- B 27,30%
- C 23,70%
- D 26,30%
Đáp án: A
Phương pháp giải:
Công thức tính khối lượng nguyên tử trung bình:
\(\overline A = \dfrac{{{x_1}.{A_1} + {x_2}.{A_2}}}{{100}}\)
(với x1 là phần trăm số nguyên tử của đồng vị A1; x2 là phần trăm số nguyên tử của đồng vị A2).
Lời giải chi tiết:
Gọi phần trăm số nguyên tử của 65Cu và 63Cu lần lượt là x và y (%)
Theo đề bài ta có:
\(\left\{ \begin{array}{l}
x + y = 100\\
\dfrac{{65x + 63y}}{{100}} = 63,546
\end{array} \right. \to \left\{ \begin{array}{l}
x = 27,3\\
y = 72,7
\end{array} \right.\)
Câu hỏi 20 :
Các electron của nguyên tử nguyên tố X được phân bố trên 2 lớp, lớp thứ hai có 4 electron. Số đơn vị điện tích hạt nhân của nguyên tử nguyên tố X là
- A
6
- B
4
- C
8
- D
12
Đáp án: A
Lời giải chi tiết:
Nguyên tử nguyên tớ X có 2 lớp e => lớp thứ nhất có 2e (số e tối đa) và lớp thứ có 4e
=> trong nguyên tử X có 6 e => Z = số p = số e = 6
Câu hỏi 21 :
Trong anion X─ có tổng số hạt cơ bản là 53, số hạt mang điện chiếm 66,04%. Cấu hình electron của X─ là
- A 1s22s22p6.
- B 1s22s22p63s23p4.
- C 1s22s22p63s23p5.
- D 1s22s22p63s23p6.
Đáp án: D
Phương pháp giải:
Hạt p: Z
Hạt e: Z + 1
Hạt n: N
=> Tổng số hạt: 2Z + N + 1, số hạt mang điện: 2Z + 1
Dựa vào dữ kiện đề bài lập 2 phương trình 2 ẩn và giải
Lời giải chi tiết:
Hạt p: Z
Hạt e: Z + 1
Hạt n: N
=> Tổng số hạt: 2Z + N + 1, số hạt mang điện: 2Z + 1
- Trong anion X─ có tổng số hạt cơ bản là 53=> 2Z + N + 1 = 53 hay 2Z + N = 52 (1)
- Số hạt mang điện chiếm 66,04% => (2Z + 1)/(2Z + N + 1) = 0,6604 hay 0,6792Z – 0,6604N = -0,3396 (2)
Giải (1) và (2) thu được Z = 17 và N = 18
Cấu hình e của X là: 1s22s22p63s23p5
=> Cấu hình e của X-: 1s22s22p63s23p6
Câu hỏi 22 :
Ở trạng thái cơ bản, nguyên tử của nguyên tố X có 4 electron ở lớp L. Số proton có trong nguyên tử X là:
- A 7
- B 6
- C 8
- D 5
Đáp án: B
Phương pháp giải:
Từ đề bài suy ra cấu hình electron của nguyên tử. Khi đó xác định được tổng số electron của nguyên tử X.
Từ đó suy ra số proton của nguyên tử X.
Lời giải chi tiết:
Ở trạng thái cơ bản, nguyên tử của nguyên tố X có 4 electron ở lớp L (lớp thứ hai).
Vậy cấu hình electron nguyên tử của X là 1s22s22p2.
Nguyên tử X có 6 electron nên nguyên tử X có 6 proton.
Câu hỏi 23 :
Tổng số các haṭ trong nguyên tử của nguyên tố R là 114. Số haṭ mang điên nhiều hơn số haṭ không mang điên là 26 hạt. Số khối của R là
- A 144
- B 79
- C 44
- D 35
Đáp án: B
Phương pháp giải:
Gọi số p = số e = Z; số n = N
- Tổng số hạt: p + e + n = 2Z + N
- Số hạt mang điện: p + e = 2Z
- Số hạt không mang điện: N
Dựa vào dữ kiện đề bài lập hệ phương trình ẩn Z, N. Giải tìm Z, N
=> Số khối A = Z + N
Lời giải chi tiết:
Gọi số p = số e = Z; số n = N
- Tổng số hạt: p + e + n = 2Z + N
- Số hạt mang điện: p + e = 2Z
- Số hạt không mang điện: N
Theo đề bài ta có:
\(\left\{ \begin{array}{l}
2Z + N = 114\\
2Z - N = 26
\end{array} \right. \to \left\{ \begin{array}{l}
Z = 35\\
N = 44
\end{array} \right.\)
=> Số khối A = Z + N = 35 + 44 = 79
Câu hỏi 24 :
Nguyên tố Y có khả năng tạo thành ion Y2+. Trong cation Y2+, tổng số hạt cơ bản là 34 hạt, trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 10 hạt. Số hiệu nguyên tử của Y là:
- A
11.
- B
12.
- C
19.
- D
20.
Đáp án: B
Phương pháp giải:
- Tổng số hạt cơ bản của Y2+: 2p + n – 2 = 34
- Số hạt mang điện nhiều hơn số hạt không mang điện: (2p – 2) – n = 10
Lời giải chi tiết:
Y2+ có : số hạt mang điện là [p + (e – 2)]
=> [p + (e – 2)] – n = 10
=> 2p – n = 12
Y2+ có 34 hạt cơ bản => Y có 34 + 2 = 36 hạt cơ bản
=> p + e + n = 2p + n = 36
=> p = 12 ( p là số hiệu nguyên tử của Y)
Câu hỏi 25 :
Hòa tan hoàn toàn 7,30 gam hỗn hợp hai kim loại kiềm X, Y (MX < MY) thuộc hai chu kì liên tiếp vào 200 gam nước thu được dung dịch Z và 7,84 lít khí hidro (đktc). Nồng độ phần trăm của YOH trong dung dịch Z là
- A 2,904%.
- B 6,389%.
- C 2,894%.
- D 1,670%.
Đáp án: A
Phương pháp giải:
Viết PTHH và tính toán theo PTHH.
Lời giải chi tiết:
Gọi công thức chung của 2 kim loại là M
M + H2O → MOH + 0,5 H2
0,7 ← 0,35 (mol)
M = 7,3/0,7 = 10,43 => Li và Na
Đặt nLi = x; nNa = y (mol)
\(\left\{ \begin{gathered}
7x + 23y = 7,3 \hfill \\
x + y = 0,7 \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
x = 0,55 \hfill \\
y = 0,15 \hfill \\
\end{gathered} \right.\)
mdd sau phản ứng = mKL + mH2O – mH2 = 7,3 + 200 – 0,35.2 = 206,6 (g)
\( \to C{\% _{NaOH}} = \dfrac{{0,15.40}}{{206,6}}.100\% = 2,904\% \)
Câu hỏi 26 :
Nguyên tố ở chu kỳ 5, nhóm VIA có cấu hình electron hóa trị là
- A
4s24p4.
- B
4s24p5.
- C
5s25p5.
- D
5s25p4.
Đáp án: D
Phương pháp giải:
+) Từ chu kì => số lớp electron
+) Từ số nhóm A => số electron lớp ngoài cùng
Lời giải chi tiết:
Nguyên tố ở chu kỳ 5 => số lớp electron là 5
Nguyên tố thuộc nhóm VIA => có 6e lớp ngoài cùng
=> cấu hình electron hóa trị là 5s25p4.
Câu hỏi 27 :
Cho các nguyên tố: X (Z = 12), Y (Z = 8), R (Z = 19), T (Z = 15). Dãy sắp xếp theo chiều bán kính nguyên tử tăng dần là
- A
X, Y, R, T.
- B
Y, X, T, R.
- C
Y, T, X, R.
- D
R, T, X, Y.
Đáp án: C
Lời giải chi tiết:
Y (Z = 8) là Oxi, thuộc chu kì 2 => có bán kính nguyên tử nhỏ nhất
X (Z = 12) là Mg và T (Z = 15) là P cùng thuộc chu kì 3 => P có độ âm điện lớn hơn Mg
=> bán kính Mg lớn hơn P (X > T)
R (Z = 19) là K thuộc chu kì 4 => R có bán kính nguyên tử lớn nhất
=> Dãy sắp xếp theo chiều bán kính nguyên tử tăng dần là : Y, T, X, R.
Câu hỏi 28 :
Dãy sắp xếp các nguyên tử theo chiều bán kính giảm dần là (Mg (Z=12), S (Z=16), Cl (Z=17), F (Z=9)).
- A Mg > S > Cl > F
- B F > Cl > S > Mg
- C S > Mg > Cl > F
- D Cl > F > S > Mg
Đáp án: A
Phương pháp giải:
1. Viết cấu hình e nguyên tử các nguyên tố
2. Từ cấu hình e suy ra vị trí của các nguyên tố trong bảng tuần hoàn
3. Dựa vào sự thay đổi của bán kính trong một nhóm và một chu kì để sắp xếp bán kính theo chiều giảm dần:
- Trong cùng một nhóm, theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử tăng dần
- Trong cùng một chu kì, theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử giảm dần
Lời giải chi tiết:
- Cấu hình e và vị trí của các nguyên tố:
12Mg: 1s22s22p63s2=> Chu kì 3, nhóm IIA
16S: 1s22s22p63s23p4 => Chu kì 3, nhóm VIA
17Cl: 1s22s22p63s23p5 => Chu kì 3, nhóm VIIA
9F: 1s22s22p5 => Chu kì 2, nhóm VIIA
Vị trí tương đối của các nguyên tử các nguyên tố trong bảng tuần hoàn:
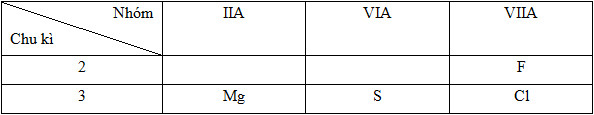
* Sự biến đổi bán kính trong bảng tuần hoàn:
- Trong cùng một nhóm, theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử tăng dần
- Trong cùng một chu kì, theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử giảm dần
Như vậy bán kính nguyên tử các nguyên tố được sắp xếp như sau: Mg > S > Cl > F
Câu hỏi 29 :
Nguyên tố Y tạo hợp chất khí với hiđro có công thức YH3. Trong hợp chất oxit cao nhất Y chiếm 25,92% về khối lượng. Xác định Y?
- A N (M= 14).
- B P (M = 31).
- C S (M = 32).
- D O (M = 16).
Đáp án: A
Phương pháp giải:
Tổng hóa trị của nguyên tố trong hợp chất với H và oxit cao nhất bằng 8
- Từ CT hợp chất khí với hiđro ta suy ra công thức oxit cao nhất
- Dựa vào phần trăm khối lượng để lập phương trình với ẩn là MY
=> MY
Lời giải chi tiết:
Nguyên tố Y tạo hợp chất khí với hiđro có công thức YH3 => CTHH của oxit cao nhất là Y2O5
\(\begin{gathered}
\% {m_Y} = \frac{{2{M_Y}}}{{2{M_Y} + 5.16}}.100\% = 25,92\% \hfill \\
\to {M_Y} = 14(Nitơ) \hfill \\
\end{gathered} \)
Câu hỏi 30 :
Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tố có tính kim loại mạnh nhất (trừ các nguyên tố có tính phóng xạ) là
- A
Na
- B
Al
- C
Fe
- D
Cs
Đáp án: D
Lời giải chi tiết:
Nguyên tố có tính kim loại mạnh nhất (trừ các nguyên tố có tính phóng xạ) là kim loại ở cuối nhóm IA => Cs
Câu hỏi 31 :
Trong tự nhiên sắt gồm 4 đồng vị 54Fe chiếm 5,8%, 56Fe chiếm 91,72%, 57Fe chiếm 2,2% và 58Fe chiếm 0,28%. Brom là hỗn hợp hai đồng vị 79Br chiếm 50,69% và 81Br chiếm 49,31%. Tính thành phần % khối lượng của 56Fe trong FeBr3 là?
- A 17,36%
- B 18,92%
- C 27,03%
- D 27,55%
Đáp án: A
Phương pháp giải:
Từ đề bài tìm nguyên tử khối trung bình của sắt và brom.
Thành phần % khối lượng của 56Fe trong FeBr3 được tính theo công thức: \({{56.0,9172} \over {{M_{FeBr3}}}}.100\% \)
Lời giải chi tiết:
Nguyên tử khối trung bình của Fe là
\(\overline {{A_{Fe}}} = {{5,8.54 + 91,72.56 + 2,2.57 + 0,28.58} \over {100}} = 55,9116\)
Nguyên tử khối trung bình của Br là:
\(\overline {{A_{Br}}} = {{79.50,69 + 81.49,31} \over {100}} = 79,9862\)
Phần trăm khối lượng của 56Fe trong FeBr3 là %m56Fe= \({{0,9172.56} \over {55,9116 + 3.79,9862}}.100\% = 17,36\% \)
Câu hỏi 32 :
X và Y là hai kim loại thuộc cùng một nhóm A trong bảng tuần hoàn các nguyên tố hóa học. Biết ZX<ZY và ZX + ZY = 24. Phát biểu nào sau đây là không đúng?
- A X, Y đều có 2 electron ở phân lớp ngoài cùng.
- B Bán kính nguyên tử của Y lớn hơn bán kính nguyên tử của X.
- C Trong bảng tuần hoàn các nguyên tố hóa học thì X, Y đều thuộc nhóm IIA.
- D Hidroxit tương ứng với oxit cao nhất của X, Y đều có tính bazo mạnh.
Đáp án: D
Lời giải chi tiết:
TH1: X, Y cách nhau 1 chu kì nhỏ
\(\left\{ \begin{gathered}
{Z_Y} - {Z_X} = 8 \hfill \\
{Z_X} + {Z_Y} = 24 \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
{Z_X} = 8 \hfill \\
{Z_Y} = 16 \hfill \\
\end{gathered} \right.\) loại do X, Y không phải là kim loại
TH2: X, Y cách nhau 1 chu kì lớn
\(\left\{ \begin{gathered}
{Z_Y} - {Z_X} = 18 \hfill \\
{Z_X} + {Z_Y} = 24 \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
{Z_X} = 3 \hfill \\
{Z_Y} = 21 \hfill \\
\end{gathered} \right.\) loại
TH3: X, Y cách nhau 2 chu kì nhỏ
\(\left\{ \begin{gathered}
{Z_Y} - {Z_X} = 8.2 \hfill \\
{Z_X} + {Z_Y} = 24 \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
{Z_X} = 4(Be) \hfill \\
{Z_Y} = 20(Ca) \hfill \\
\end{gathered} \right.\)
Be: 1s22s2
Ca: 1s22s22p63s23p64s2
A, B, C đúng
D sai vì Be(OH)2 có tính bazơ yếu
Câu hỏi 33 :
Hợp chất M được tạo bởi cation X+ và anion Y2-. Trong đó X+ có cấu hình electron lớp ngoài cùng là 2s22p6 và Y2- do 5 nguyên tử của 2 nguyên tố tạo nên, tổng số electron trong Y2- là 50. Biết hai nguyên tố trong Y2- thuộc cùng một nhóm A và hai chu kì liên tiếp. Xác định công thức phân tử của M.
- A
CaSO4
- B
Na2SO4
- C
K3PO4
- D
Na3PO4
Đáp án: B
Phương pháp giải:
+) Từ cấu hình electron lớp ngoài cùng của X+ => cấu hình e của X
Gọi Y2-: AxBy2-
+) Tính ZTB => vị trí của A và B trong BTH
+) Lập bảng, biện luận công thức của Y
Lời giải chi tiết:
X+ có cấu hình electron lớp ngoài cùng là 2s22p6
=> Cấu hình e của X: 1s22s22p63s1 (Z = 11)
=> X là natri (Na)
Gọi Y2-: AxBy2-
Ta có: $\left\{ {\begin{array}{*{20}{l}}{x + y = 5}\\{x.{Z_A} + y.{Z_B} = 50 - 2 = 48}\end{array}} \right. \Rightarrow {Z_{TB}} =\;\frac{{48}}{5} = 9,6$
=> A, B thuộc chu kì 2 và 3 trong bảng tuần hoàn.
=> ZB - ZA = 8 Û ZB = 8 + ZA.
=> $\left\{ {\begin{array}{*{20}{l}}{x + y = 5}\\{x{Z_A} + y(8 + {Z_A}) = 48}\end{array}} \right.$ => ZA= $\frac{48-8y}{5}$
Lập bảng, y = 1,2,3,4 => Nghiệm hợp lí khi y=1; ZA=8
Với ZA = 8 → A là oxi
ZB = 16 → B là lưu huỳnh
y = 1=> x = 4 => Y2-là SO42-
Vậy M là Na2SO4
Câu hỏi 34 :
Trong thiên nhiên Ag có 2 đồng vị, đồng vị 44Ag107(56%). Tính số khối của đồng vị thứ hai. Biết nguyên tử khối trung bình của Ag là 107,88.
- A 109
- B 107
- C 108
- D 110
Đáp án: A
Phương pháp giải:
![]()
Lời giải chi tiết:
% của đồng vị còn lại là : 100 % - 56 % = 44 %
=> ![]() => X = 109
=> X = 109
=> Đáp án A
Câu hỏi 35 :
Bán kính nguyên tử và khối lượng mol nguyên tử Fe lần lượt là 1,28A và 56 gam/mol. Biết rằng trong tinh thể, các nguyên tử Fe chiếm 74% thể tích, phần còn lại là rỗng. Khối lượng riêng của Fe là
- A
10,59.
- B
7,84.
- C
10,54.
- D
11,35.
Đáp án: B
Phương pháp giải:
1 mol = 6,02.1023 nguyên tử Fe nặng 56 gam => Khối lượng 1 nguyên tử Fe = m = 56 / (6,02.1023) gam
Thể tích 1 nguyên tử $Fe{\rm{ }} = V = \frac{4}{3}\pi .{R^3}$ \( = > \,\,d = \frac{m}{V}\)
Lời giải chi tiết:
Đổi 1,28\(\mathop A\limits^o \)= 1,28.10-8 cm
1 mol = 6,02.1023 nguyên tử Fe nặng 56 gam => Khối lượng 1 nguyên tử Fe = m = 56 / (6,02.1023) gam
Thể tích 1 nguyên tử $Fe{\rm{ }} = V = \frac{4}{3}\pi .{R^3} = \frac{4}{3}\pi .{(1,{28.10^{ - 8}})^3}\,\,c{m^3}$
\( = > \,\,d = \frac{m}{V} = 10,59\,\,gam/c{m^3}\)
Vì Fe chỉ chiếm 74% thể tích tinh thể nên khối lượng riêng thật sự của Fe = 10,59.0,74 = 7,84 gam/cm3
