Câu hỏi 1 :
Cho FeS tác dụng với dung dịch H2SO4 loãng, thu được khí A; nếu dùng dung dịch H2SO4 đặc, nóng thì thu được khí B. Dẫn khí B vào dung dịch A thu được rắn C. Các chất A, B, C lần lượt là:
- A
H2, H2S, S.
- B
H2S, SO2, S.
- C
H2, SO2, S.
- D
O2, SO2, SO3.
Đáp án: B
Phương pháp giải:
Xem lại lí thuyết tính chất hóa học của SO2
Lời giải chi tiết:
FeS + H2SO4 → FeSO4 + H2S (A)
2FeS + 10H2SO4 đặc → Fe2(SO4)3 + 9SO2 (B)+ 10H2O
2H2S + SO2 → 3S (C) + 2H2O
=> những khí tác dụng được với NaOH là: H2S (A), SO2 (B), S (C)
Câu hỏi 2 :
Để nhận biết dung dịch H2SO4 và dung dịch HCl người ta dùng
- A
CuCl2.
- B
NaNO3.
- C
MgSO4.
- D
BaCl2.
Đáp án: D
Phương pháp giải:
Để nhận biết H2SO4 loãng và HCl ta cần chú ý tới tính tan của muối sunfat và muối clorua
Câu hỏi 3 :
Vị trí của nguyên tố oxi trong bảng tuần hoàn hóa học là
- A
ô thứ 8, chu kì 3, nhóm VIA
- B
ô thứ 8, chu kì 2, nhóm VIA
- C
ô thứ 16, chu kì 3, nhóm VIA
- D
ô thứ 16, chu kì 2, nhóm VIA
Đáp án: B
Phương pháp giải:
Viết cấu hình của oxi => Kết luận
Lời giải chi tiết:
Cấu hình của oxi: 1s22s22p4=> oxi thuộc ô thứ 8, chu kì 2, nhóm VIA
Câu hỏi 4 :
Dung dịch NaCl bị lẫn NaI. Để làm sạch dung dịch NaCl có thể dùng:
- A
AgNO3.
- B
Br2.
- C
Cl2.
- D
Hồ tinh bột.
Đáp án: C
Phương pháp giải:
+) Nguyên tắc làm sạch chất dùng để làm sạch tác dụng với chất cần loại bỏ, không tạo ra chất mới.
+) Tính chất NaI => Chất cần dùng
Lời giải chi tiết:
Dùng Cl2 sẽ có phản ứng :
Cl2 + 2NaI -> 2NaCl + I2
=> sau phản ứng chỉ có NaCl mà không có muối khác. I2 không tan trong nước cũng dễ lọc tách.
Câu hỏi 5 :
Hệ số của O2 trong phương trình: H2S + O2 → H2O + SO2 là bao nhiêu?
- A
1
- B
2
- C
3
- D
4
Đáp án: C
Phương pháp giải:
Cân bằng PTHH, sau đó cộng tổng các hệ số
Lời giải chi tiết:
2H2S + 3O2 → 2H2O + 2SO2
=> hệ số của O2 là 3
Câu hỏi 6 :
Trong nhóm halogen, sự biến đổi tính chất nào sau đây của đơn chất đi từ flo đến iot là đúng ?
- A
Ở điều kiện thường, trạng thái tập hợp chuyển từ thể khí sang thể lỏng và rắn
- B
Màu sắc nhạt dần
- C
Nhiệt độ nóng chảy giảm đân
- D
Tính oxi hóa tăng dần
Đáp án: A
Phương pháp giải:
Xem lại lí thuyết halogen
Lời giải chi tiết:
đơn chất đi từ flo đến iot: trạng thái tập hợp chuyển từ thể khí sang thể lỏng và rắn
Câu hỏi 7 :
Chất có khả năng ăn mòn thủy tinh SiO2 là
- A H2SO4
- B Mg.
- C NaOH.
- D HF.
Đáp án: D
Phương pháp giải:
Dựa vào kiến thức được học về silic trong sgk hóa 11
Lời giải chi tiết:
HF là axit có khả năng ăn mòn thủy tinh do có phản ứng:
4HF + SiO2 → SiF4 + 2H2O
Câu hỏi 8 :
Cho các chất rắn sau: Cr2O3, Fe(NO3)2, Al(OH)3, Mg. Số chất tan được trong dung dịch HCl loãng nguội (dư) là
- A
1
- B
2
- C
3
- D
4
Đáp án: D
Lời giải chi tiết:
Tất cả 4 chất đều tan trong dd HCl loãng nguội
Cr2O3 + 6HCl → 2CrCl3 + 3H2O
9Fe(NO3)2 + 12HCl → 4FeCl3 + 5Fe(NO3)3 + 4NO + 6H2O
2Al(OH)3 + 6HCl → 2AlCl3 + 6H2O
Mg + 2HCl → MgCl2 + H2↑
Câu hỏi 9 :
Clorua vôi có công thức là:
- A
CaCl2.
- B
CaOCl.
- C
CaOCl2.
- D
Ca(OCl)2.
Đáp án: C
Lời giải chi tiết:
Clorua vôi có công thức là: CaOCl2.
Câu hỏi 10 :
Ion X2- có cấu hình electron lớp ngoài cùng là 2s22p6. X là nguyên tố nào sau đây?
- A
Oxi
- B
Lưu huỳnh
- C
Clo
- D
Flo
Đáp án: A
Phương pháp giải:
Xem lại lí thuyết phần II – khái quát về nhóm VIA
Lời giải chi tiết:
=> cấu hình e của anion X2- là 2s22p6 => Cấu hình electron của X là : 1s22s22p4
X là oxi
Câu hỏi 11 :
Đơn chất vừa có tính oxi hóa vừa có tính khử là
- A
F2
- B
O3
- C
S
- D
O2
Đáp án: C
Phương pháp giải:
Xem lại lí thuyết tính chất hóa học của S
Lời giải chi tiết:
S vừa có tính oxi hóa, vừa có tính khử vì S có mức oxi hóa trung gian.
Câu hỏi 12 :
Sục Cl2 vào nước, thu được nước clo màu vàng nhạt. Trong nước clo có chứa các chất là
- A
Cl2, H2O
- B
HCl, HClO
- C
HCl, HClO, H2O
- D
Cl2, HCl, HClO, H2O
Đáp án: D
Lời giải chi tiết:
Cl2 có phản ứng thuận nghịch với nước:
H2O + Cl2 HCl + HClO (axit clohiđric và axit hipoclorơ)
Ngoài ra clo tan trong nước theo kiểu vật lí
=> trong nước clo có chứa Cl2, HCl, HClO, H2O.
Câu hỏi 13 :
Cho các chất sau: Cl2, H2, Fe(OH)2, CO2, SO2, Ag, Fe, Na. Oxi không thể phản ứng được với
- A
Cl2, CO2, Ag.
- B
CO2, Ag.
- C
Ag.
- D
Cl2, CO2, SO2, Ag.
Đáp án: A
Lời giải chi tiết:
Oxi không thể phản ứng được với Cl2, CO2, Ag.
Câu hỏi 14 :
Đốt cháy đơn chất X trong oxi thu được khí Y. Mặt khác, X phản ứng với H2 (khi đun nóng) thu được khí Z. Trộn hai khí Y và Z thu được chất rắn màu vàng. Đơn chất X là:
- A
lưu huỳnh.
- B
cacbon.
- C
photpho.
- D
nitơ.
Đáp án: A
Phương pháp giải:
Xem lại tính chất hóa học của lưu huỳnh
Lời giải chi tiết:
X là lưu huỳnh
PTHH:
S+ O2 → SO2 (khí Y)
S + H2 →H2S (khí Z)
SO2 + H2S → S (vàng) + H2O
Câu hỏi 15 :
Cho các phản ứng hóa học sau:
(a) S + O2 $\xrightarrow{{{t^ \circ }}}$ SO2
(b) S + 3F2 $\xrightarrow{{{t^ \circ }}}$ SF6
(c) S + Hg $\xrightarrow{{}}$ HgS
(d) S + 6HNO3 (đặc) $\xrightarrow{{{t^ \circ }}}$ H2SO4 + 6NO2 + 2H2O
Số phản ứng trong đó S thể hiện tính khử là :
- A
2.
- B
3.
- C
1.
- D
4.
Đáp án: B
Phương pháp giải:
+) Tính khử là khả năng nhường electron
=> Xác định số oxi hóa của S
=> Phản ứng
Lời giải chi tiết:
\(\mathop S\limits^0 \;\; + \;\;{O_2}\;\;\;\xrightarrow{{{t^o}}}\;\;\mathop S\limits^{ + 4} {O_2}\)
\(\mathop S\limits^0 \;\; + \;\;3{F_2}\;\;\;\xrightarrow{{{t^o}}}\;\;\mathop S\limits^{ + 6} {F_6}\)
\(\mathop S\limits^0 \) + 6HNO3(đặc) \(\xrightarrow{{{t^o}}}\) \(\mathop{{H_2}S{O_4}}\limits^{ + 6} \) + 6NO2 + 2H2O
Câu hỏi 16 :
SO2 luôn thể hiện tính khử trong các phản ứng với
- A
H2S, O2, nước Br2
- B
Dung dịch NaOH, O2, dung dịch KMnO4.
- C
Dung dịch KOH, CaO, nước Br2.
- D
O2, nước Br2, dung dịch KMnO4.
Đáp án: D
Phương pháp giải:
+) SO2 luôn thể hiện tính khử khi tác dụng với các chất oxi hóa mạnh như : O2, KMnO4, Br2,....
=> Loại trừ đáp án
Lời giải chi tiết:
SO2 luôn thể hiện tính khử khi tác dụng với các chất oxi hóa mạnh như : O2, KMnO4, Br2,....
A Sai vì H2S có tính khử ${H_2}\mathop S\limits^{ - 2} \,\,\, + \,\,\,\,\mathop S\limits^{ + 4} {O_2}\xrightarrow{{}}\mathop S\limits^0 \,\, \downarrow \,\, + \,\,\,{H_2}O$
B Sai vì $2KOH\,\,\, + \,\,\,\,\mathop S\limits^{ + 4} {O_2}\xrightarrow{{}}{K_2}\mathop S\limits^{ + 4} {O_3}\,\,\, + \,\,\,{H_2}O$
$CaO\,\,\, + \,\,\,\mathop S\limits^{ + 4} {O_2}\xrightarrow{{}}Ca\mathop S\limits^{ + 4} {O_3}$
C Sai vì $2NaOH\,\,\, + \,\,\,\,\mathop S\limits^{ + 4} {O_2}\xrightarrow{{}}N{a_2}\mathop S\limits^{ + 4} {O_3}\,\,\, + \,\,\,{H_2}O$
D Đúng vì:
PTHH : $2\mathop S\limits^{ + 4} {O_2}\,\,\, + \,\,\,{O_2}\underset{{{t^o}}}{\overset{{{V_2}{O_5}}}{\longleftrightarrow}}2\mathop S\limits^{ + 6} {O_3}\,$
$\mathop S\limits^{ + 4} {O_2}\,\,\, + \,\,\,B{r_2}\,\,\, + \,\,2{H_2}O\xrightarrow{{}}\,\,2HBr\,\,\, + \,\,\,{H_2}\mathop S\limits^{ + 6} {O_4}$
$5\mathop S\limits^{ + 4} {O_2}\,\,\, + \,\,\,\,2KMn{O_4}\,\,\, + \,\,\,2{H_2}O\xrightarrow{{}}\,\,\,{K_2}\mathop S\limits^{ + 6} {O_4}\,\,\, + \,\,\,2Mn\mathop S\limits^{ + 6} {O_4}\,\,\,\, + \,\,\,2{H_2}\mathop S\limits^{ + 6} {O_4}$
Câu hỏi 17 :
Thực hiện thí nghiệm điều chế clo theo sơ đồ sau:
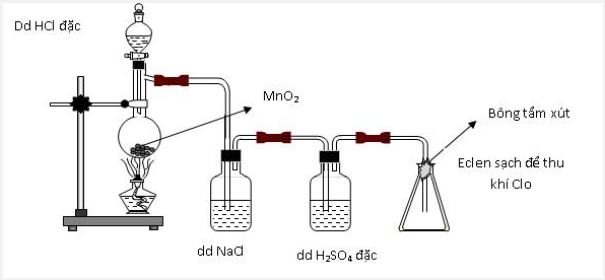
Cho các nhận định sau:
(a) Bình chứa dung dịch NaCl dùng để giữ khí HCl.
(b) Bình chứa dung dịch H2SO4 đặc để giữ hơi nước.
(c) Bông tẩm dung dịch xút có thể thay bằng tẩm nước.
(d) Có thể thay chất rắn trong bình cầu thành thuốc tím.
Số nhận định chính xác là:
- A 1
- B 2
- C 3
- D 4
Đáp án: C
Lời giải chi tiết:
(a) Bình chứa dung dịch NaCl dùng để giữ khí HCl.
=> đúng
(b) Bình chứa dung dịch H2SO4 đặc để giữ hơi nước.
=> đúng
(c) Bông tẩm dung dịch xút có thể thay bằng tẩm nước.
=> sai vì nước không giữ được khí clo vì nước phản ứng rất yếu với clo
(d) Có thể thay chất rắn trong bình cầu thành thuốc tím.
=> đúng vì thuốc tím cũng là một chất oxi hóa mạnh tương tự như MnO2
Vậy có 3 phát biểu đúng.
Câu hỏi 18 :
Cho axit H2SO4 đặc, dư tác dụng vừa đủ với 29,25 gam NaCl đun nóng. Khí thu được hòa tan vào 73 gam H2O. Nồng độ phần trăm của HCl trong dung dịch thu được là
- A
20%
- B
25%
- C
23,5%
- D
22%
Đáp án: A
Phương pháp giải:
+) Bảo toàn nguyên tố Cl: nHCl = nNaCl
+) Tính $C\% = \dfrac{{{m_{ct}}}}{{{m_{dd}}}}.100\% $
Lời giải chi tiết:
nNaCl = 0,5 mol
Bảo toàn nguyên tố Cl: nHCl = nNaCl = 0,5 mol
Khối lượng dung dịch thu được: mdd = mHCl + mH2O = 0,5 . 35,5 + 73 (gam)
Hòa tan HCl vào nước => $C{\% _{HCl}} = \dfrac{{{m_{HCl}}}}{{{m_{{\rm{dd}}}}}} = \dfrac{{0,5.36,5}}{{73 + 0,5.36,5}}.100\% = 20\% $
Câu hỏi 19 :
Nung m gam hỗn hợp KClO3 một thời gian thu được hỗn hợp chất rắn trong đó phần trăm khối lượng của oxi là 9,6%, của KCl là 74,5%. Phần trăm KClO3 bị phân hủy là:
- A
96,75%
- B
90%
- C
88%
- D
95%
Đáp án: A
Phương pháp giải:
\(\begin{gathered}2KCl{O_3}\xrightarrow{{{t^0}}}2KCl + 3{O_2}\,\,\,(1) \hfill \\4KCl{O_3}\xrightarrow{{{t^0}}}3KCl{O_4} + KCl\,\,\,(2) \hfill \\ \end{gathered} \)
Lời giải chi tiết:
\(\begin{gathered}2KCl{O_3}\xrightarrow{{{t^0}}}2KCl + 3{O_2}\,\,\,(1) \hfill \\4KCl{O_3}\xrightarrow{{{t^0}}}3KCl{O_4} + KCl\,\,\,(2) \hfill \\ \end{gathered} \)
Đặt nKCl = 1 mol => \(m = \dfrac{{1.74,5}}{{0,745}} = 100\,\,gam\)
mO= 9,6 gam => nO = 0,6 mol
nKClO4 = nO : 4 = 0,15 mol; nKCl(2) = 0,15: 3 = 0,05 mol
=> nKCl(1) = 1- 0,05 = 0,95 mol
=> nKClO3 dư = m – mKCl - mKClO4 = 100- 74,5 – 0,15. 138,5 = 4,725 gam
=> nKClO3 dư = 27/700 (mol)
%KClO3 bị phân hủy là: \(\dfrac{{1,15}}{{1,15 + \dfrac{{27}}{{700}}}}.100\% = 96,75\% \)
Câu hỏi 20 :
Cho V lít khí Cl2 (đktc) vào dung dịch chứa 30gam NaI và 30,9 gam NaBr. Sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cô cạn dung dịch Y thu được 33,7 gam muối khan Z. Giá trị của V và phần trăm khối lượng các muối trong Z là:
- A
V = 4,48 lít và %mNaCl = 69,44% ; %mNaBr = 30,56%.
- B
V = 4,48 lít và %mNaCl = 30,56% ; %mNaBr = 69,44%.
- C
V = 5,6 lít và %mNaCl = 69,44% ; %mNaBr = 30,56%.
- D
V = 5,6 lít và %mNaCl = 50% ; %mNaBr = 50%.
Đáp án: A
Phương pháp giải:
Bước 1: Viết các PTHH xảy ra
Tính khử của I- mạnh hơn Br- nên phản ứng theo thứ tự
Cl2 + 2NaI → 2NaCl + I2 (1)
Cl2 + 2NaBr → 2NaCl + Br2 (2)
Bước 2: Giả sử các phản ứng xảy ra theo tuần tự (1) và (2). Xác định số liệu cho trong đề ra nằm ở giai đoạn nào
Mốc 1: Xảy ra vừa đủ phản ứng (1) thì khối lượng rắn giảm m1 = mNaI – mNaCl = ?
Mốc 2: Xảy ra phản ứng (1) và (2) vừa đủ thì khối lượng rắn giảm là:
m2 = (mNaI – mNaCl(1)) + (nNaBr – mNaCl(2)) = ?
Bước 3: So sánh số liệu chất rắn giảm trong đề với 2 mốc → xác định phản ứng xảy ra đến giai đoạn nào
Giả sử từ số liệu ta tính được khối lượng chất rắn giảm là a (g)
+ Nếu a < m1 → phản ứng chỉ xảy ra theo (1); NaI chưa pư hết
+ Nếu a = m1 → phản ứng xảy ra xong theo (1); NaI pư hết
+ Nếu m1 < a < m2 thì phản ứng xảy ra xong (1); phản ứng (2) chưa xảy ra xong. NaI pư hết, NaBr vẫn còn dư
+ Nếu a = m2 thì phản ứng xảy ra xong theo (1) và (2). NaI và NaBr đều pư hết.
Bước 4: Xác định giá trị cần tìm
Lời giải chi tiết:
Tính khử của I- mạnh hơn Br- nên phản ứng theo thứ tự
Cl2 + 2NaI → 2NaCl + I2 (1)
(mol) 0,1← 0,2 mol → 0,2 mol
khối lượng giảm là: m1 = mNaI – mNaCl = 0,2.150 – 0,2.58,5 = 18,3 (g)
Cl2 + 2NaBr → 2NaCl + Br2 (2)
(mol) 0,3 mol → 0,3 mol
khối lượng giảm là: m’ = mNaBr – mNaCl = 0,3.103 – 0,3.58,5 = 13,35 (g)
Mốc 1: Xảy ra vừa đủ phản ứng (1) thì khối lượng rắn giảm m1 = 18,3 (g)
Mốc 2: Xảy ra phản ứng (1) và (2) vừa đủ thì khối lượng rắn giảm là: m2 = m1 + m’ = 18,3 + 13,35 = 31,65 (g)
Theo bài: mrắn giảm = mNaI + mNaBr – mZ = 30 + 30,9 – 33,7 = 27,2 (g)
Ta thấy: m1 = 18,3 g < m rắn giảm = 27,2 g < m2 = 31,65 g
=> xảy ra phản ứng (1) và (2). Cl2; NaI pư hết, NaBr dư
Ta có: mrắn giảm (2) = 27,2 – 18,3 = 8,9 (g)
Cl2 + 2NaBr → 2NaCl + Br2 (3)
Cứ (mol) 1 mol → 1 mol khối lượng giảm là 44,5g
Vậy (mol) 0,1← 0,2 mol ← 0,2 mol ← khối lượng giảm là 8,9 g
Vậy ∑ nCl2 pư = nCl2 (1) + nCl2 (3) = 0,1 + 0,1 = 0,2 (mol) → VCl2(đktc) = 0,2.22,4 = 4,48 (lít)
Hh muối Z gồm: NaCl: 0,4 (mol) và NaBr dư: 0,3 – 0,2 = 0,1 (mol)
\(\left\{ \begin{array}{l}\% {m_{NaCl}} = \frac{{{m_{NaCl}}}}{{{m_Z}}}.100\% = \frac{{0,4.58,5}}{{33,7}}.100\% = 69,44\% \\\% {m_{NaBr}} = 100\% - \% {m_{NaCl}} = 30,56\% \end{array} \right.\)
Câu hỏi 21 :
Đốt 13 gam bột một kim loại hóa trị II trong oxi dư đến khối lượng không đổi thu được chất rắn X có khối lượng 16,2 gam (giả sử hiệu suất phản ứng là 100%). Kim loại đó là
- A
Fe.
- B
Cu.
- C
Zn.
- D
Ca.
Đáp án: C
Phương pháp giải:
+) Bảo toàn khối lượng: \({{m}_{R}}+{{m}_{{{O}_{2}}}}={{m}_{X}}=>{{m}_{{{O}_{2}}}}\)
4R + nO2 → 2R2On
$\frac{{0,4}}{n}$ ← 0,1
$ = > {\text{ }}{M_R}$
Lời giải chi tiết:
Gọi kim loại là R có hóa trị là n
Bảo toàn khối lượng: \({{m}_{R}}+{{m}_{{{O}_{2}}}}={{m}_{X}}=>{{m}_{{{O}_{2}}}}=16,213=3,2\text{ }gam\)
=> nO2 = 0,1 mol
4R + nO2 → 2R2On
$\frac{{0,4}}{n}$ ← 0,1
$ = > {\text{ }}{M_R} = \frac{{13}}{{\frac{{0,4}}{n}}} = 32,5n$
Với n = 2 => R = 65 => R là kim loại Zn
Câu hỏi 22 :
Hấp thụ hoàn toàn 6,4 gam SO2 vào dung dịch NaOH 1M, sau phản ứng thu được 11,5 gam muối. Thể tích dung dịch NaOH cần là
- A
150 ml
- B
250 ml
- C
200 ml
- D
275 ml
Đáp án: A
Phương pháp giải:
n SO2 = 0,1 mol
Giả sử phản ứng tạo 1 muối NaHSO3
BTNT S: nNaHSO3 = nSO2 = 0,1 => m muối = 10,4 gam < 11,5 gam
Giả sử phản ứng tạo 1 muối Na2SO3
BTNT S: nNa2SO3 = nSO2 = 0,1 => m muối = 12,6 gam > 11,5 gam
Chứng tỏ phản ứng tạo hỗn hợp 2 muối NaHSO3 (a mol) và Na2SO3 (b mol)
Lập hệ phương trình 2 ẩn a, b
BTNT Na => n NaOH = 2n Na2SO3 + n NaHSO3
=> VNaOH
Lời giải chi tiết:
n SO2 = 0,1 mol
Giả sử phản ứng tạo 1 muối NaHSO3
BTNT S: nNaHSO3 = nSO2 = 0,1 => m muối = 10,4 gam < 11,5 gam
Giả sử phản ứng tạo 1 muối Na2SO3
BTNT S: nNa2SO3 = nSO2 = 0,1 => m muối = 12,6 gam > 11,5 gam
Chứng tỏ phản ứng tạo hỗn hợp 2 muối NaHSO3 (a mol) và Na2SO3 (b mol)
Ta có hpt: \(\left\{ \begin{gathered}a + b = 0,1 \hfill \\104a + 126b = 11,5 \hfill \\ \end{gathered} \right. = > \left\{ \begin{gathered}a = 0,05 \hfill \\b = 0,05 \hfill \\ \end{gathered} \right.\)
BTNT Na => n NaOH = 2n Na2SO3 + n NaHSO3 = 0,15 mol
VNaOH = 0,15 :1 = 0,15 lít = 150ml
Câu hỏi 23 :
Nhúng thanh sắt dư vào 200 ml dung dịch chứa HCl 0,2M và mol H2SO4 0,1M đến khi phản ứng hoàn toàn thu được V lít khí. Giá trị của V là
- A
0,448.
- B
1,344.
- C
0,896.
- D
1,792.
Đáp án: C
Phương pháp giải:
Tính theo phương trình hoặc theo bảo toàn nguyên tố H: ${{n}_{{{H}_{2}}}}=\dfrac{1}{2}.\sum{{{n}_{{{H}^{+}}}}}$
Lời giải chi tiết:
${n_{HCl}} = 0,2.0,2 = 0,4\,mol;\,{n_{{H_2}S{O_4}}} = 0,2.0,1 = 0,02\,mol$
Fe + 2HCl → FeCl2 + H2
0,02 ← 0,04 → 0,02
Fe + H2SO4 → FeSO4 + H2
0,02 ← 0,02 → 0,02
→ ${n_{{H_2}}} = 0,02 + 0,02 = 0,04\,\to \,{V_{{H_2}}} = 0,04.22,4 = 0,896$ lít
Câu hỏi 24 :
Để khử hoàn toàn 3,04 gam hỗn hợp X gồm FeO, Fe3O4, Fe2O3, cần 0,05 mol H2. Mặt khác hoà tan hoàn toàn 3,04 gam hỗn hợp X trong dung dịch H2SO4 đặc nóng thì thu được thể tích V ml SO2 (đktc). Giá trị V(ml) là:
- A
112ml
- B
224 ml
- C
336 ml
- D
448 ml
Đáp án: B
Phương pháp giải:
Qui hỗn hợp X về FeO (x mol) và Fe2O3 (y mol)
Ta có: \(\left\{ \begin{gathered}x + 3y = 0,05 \hfill \\72x + 160y = 3,04 \hfill \\ \end{gathered} \right. = > \left\{ \begin{gathered}x = 0,02 \hfill \\y = 0,01 \hfill \\ \end{gathered} \right.\)
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2+ 4H2O
0,02 0,01
=> VSO2
Lời giải chi tiết:
Qui hỗn hợp X về FeO (x mol) và Fe2O3 (y mol)
Ta có:
FeO + H2 → Fe + H2O
x x x
Fe2O3 + 3H2 → 2Fe + 3H2O
y 3y 2y
Ta có: \(\left\{ \begin{gathered}x + 3y = 0,05 \hfill \\72x + 160y = 3,04 \hfill \\ \end{gathered} \right. = > \left\{ \begin{gathered} x = 0,02 \hfill \\y = 0,01 \hfill \\ \end{gathered} \right.\)
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2+ 4H2O
0,02 0,01
Vậy VSO2 = 0,01. 22,4 = 0,224 lít = 224 ml
Câu hỏi 25 :
Hãy xác định công thức của oleum A, biết rằng khi hoà tan 3,38 gam A vào nước người ta phải dung 800 ml dung dịch KOH 0,1M để trung hòa dung dịch A
- A
H2SO4.5SO3
- B
H2SO4.6SO3
- C
H2SO4.3SO3
- D
H2SO4.4SO3
Đáp án: C
Phương pháp giải:
+) Gọi công thức của oleum A là H2SO4.nSO3
+) Bảo toàn nguyên tố S, ta có:
\({n_{{H_2}S{O_4}\,\,trong\,{\text{dd}}\,A}} = (1 + n){n_{{H_2}S{O_4}.nS{O_3}}} \to {n_{{H_2}S{O_4}.nS{O_3}}}\)
+) Tính số mol H2SO4 trong dung dịch A bằng phản ứng trung hòa
+) Tính số mol oleum theo khối lượng cho sẵn
+) Từ 2 số mol => Lập biểu thức tính n
Lời giải chi tiết:
Gọi công thức của A là H2SO4.nSO3
Bảo toàn nguyên tố S, ta có
\({n_{{H_2}S{O_4}\,\,trong\,{\text{dd}}\,A}} = (1 + n){n_{{H_2}S{O_4}.nS{O_3}}} \to {n_{{H_2}S{O_4}.nS{O_3}}} = \dfrac{{{n_{{H_2}S{O_4}trong{\text{ddA}}}}}}{{n + 1}}\)
Trung hòa dung dịch A cần 0,08 mol KOH
2KOH + H2SO4 → K2SO4 + 2H2O
0,08 mol → 0,04 mol
\( \to {n_{{H_2}S{O_4}.nS{O_3}}} = \dfrac{{{n_{{H_2}S{O_4}trong{\text{ddA}}}}}}{{n + 1}} = \dfrac{{0,04}}{{n + 1}}\)
Mặt khác, \( \to {n_{{H_2}S{O_4}.nS{O_3}}} = \dfrac{{3,38}}{{98 + 80n}}\) mol
\( \to \dfrac{{3,38}}{{98 + 80n}} = \dfrac{{0,04}}{{n + 1}}\)
\( \to n = 3\)
Câu hỏi 26 :
Khi nhiệt phân hoàn toàn 100 gam mỗi chất sau: KClO3 (xúc tác MnO2), KMnO4, KNO3 và AgNO3. Chất tạo ra lượng O2 lớn nhất là
- A
KClO3.
- B
KMnO4.
- C
KNO3.
- D
AgNO3.
Đáp án: A
Phương pháp giải:
+) Đổi số mol, viết PTHH, tính theo PTHH
=> Kết luận
Lời giải chi tiết:
$KCl{O_3}\xrightarrow{{{t^o},Mn{O_2}}}KCl\,\,\,\, + \,\,\,\frac{3}{2}{O_2} \uparrow $
$ \to {n_{{O_2}}} = \frac{3}{2}{n_{KCl{O_3}}} = \frac{3}{2} \cdot \frac{{100}}{{122,5}} \approx 1,224\,mol$
$2KMn{O_4}\xrightarrow{{{t^o}}}{K_2}Mn{O_4}\,\,\, + \,\,\,\,Mn{O_2}\,\,\,\, + \,\,\,{O_2}$$ \uparrow $
$ \to {n_{{O_2}}} = \frac{1}{2}{n_{KMn{O_4}}} = \frac{1}{2} \cdot \frac{{100}}{{158}} \approx 0,316\,mol$
$KN{O_3}\xrightarrow{{{t^o}}}KN{O_2}\,\,\,\, + \,\,\,\frac{1}{2}{O_2}$$ \uparrow $
$ \to {n_{{O_2}}} = \frac{1}{2}{n_{KN{O_3}}} = \frac{1}{2} \cdot \frac{{100}}{{101}} \approx 0,495mol$
$AgN{O_3}\xrightarrow{{{t^o}}}Ag\,\,\,\,\, + \,\,\,\,N{O_2}\,\,\,\, + \,\,\,\frac{1}{2}{O_2}$$ \uparrow $
$ \to {n_{{O_2}}} = \frac{1}{2}{n_{AgN{O_3}}} = \frac{1}{2} \cdot \frac{{100}}{{170}} \approx 0,294mol$
Câu hỏi 27 :
Hoà tan hoàn toàn 4,0 gam hỗn hợp Mg, Fe, Cu bằng dung dịch H2SO4 đặc, nóng, dư thu được 2,24 lít khí SO2 duy nhất (đktc) và dung dịch chứa m gam muối. Giá trị của m là
- A
23,2.
- B
13,6.
- C
12,8.
- D
14,4.
Đáp án: B
Phương pháp giải:
+) Coi hỗn hợp kim loại là M số oxi hóa là n
\(2\mathop {M{\rm{ }}}\limits^0 -2ne{\rm{ }} \to {M_2}{(S{O_4})_n} \to nSO_4^{2 - }\)
\(\mathop S\limits^{ + 6} + 2e \to \mathop S\limits^{ + 4} {O_2}\)
Áp dụng định luật bảo toàn electron ta có: \({n_{SO_4^{2 - }}}\) (trong muối) = nSO2
+) mmuối = mKim loại + mSO4
Lời giải chi tiết:
Coi hỗn hợp kim loại là M số oxi hóa là n
\(2\mathop {M{\rm{ }}}\limits^0 -2ne{\rm{ }} \to {M_2}{(S{O_4})_n} \to nSO_4^{2 - }\)
0,2 → 0,1
\(\mathop S\limits^{ + 6} + 2e \to \mathop S\limits^{ + 4} {O_2}\)
0,2\( \leftarrow \) 0,1
Áp dụng định luật bảo toàn electron ta có: \({n_{SO_4^{2 - }}}\) (trong muối) = nSO2
mmuối = mKim loại + mSO4 = 4 + 0,1.96= 13,6 gam
Câu hỏi 28 :
Hỗn hợp a gồm Cu và CuO Hòa tan hoàn toàn 20,8 gam hỗn hợp a vào 73,5 gam dung dịch H2SO4 80% chỉ thu được dung dịch x và khí SO2 là sản phẩm khử duy nhất cho x tác dụng hoàn toàn với 900 ml dung dịch NaOH 1M sau đó lọc bỏ kết tủa được dung dịch y cô cạn y thu được chất rắn z nặng 60,8 g nồng độ phần trăm của CuSO4 trong x.
- A 68,90%.
- B 58,90%.
- C 61,09%.
- D 59,8%.
Đáp án: B
Phương pháp giải:
Sử dụng bảo toàn e và bảo toàn nguyên tố.
Lời giải chi tiết:
Tóm tắt bài toán:
\(20,8\,(g)\,A\left\{ \begin{array}{l}Cu\\CuO\end{array} \right. + 73,5\,g\,dd\,\underbrace {{H_2}S{O_4}}_{0,6\,(mol)} \to \left\langle \begin{array}{l}S{O_2}:\\\left. {X\left\{ \begin{array}{l}CuS{O_4}:\\{H_2}S{O_4}\,du\end{array} \right.} \right\} + \underbrace {NaOH}_{0,9\,(mol)} \to \left\{ \begin{array}{l} \downarrow Cu{(OH)_2}\\60,8\,(g)\,Z\left\{ \begin{array}{l}N{a_2}S{O_4}:a\,(mol)\\NaOH\,du:\,b(mol)\end{array} \right.\end{array} \right.\end{array} \right.\)
Đặt trong Z số mol Na2SO4 và NaOH dư lần lượt là a và b (mol)
Ta có hệ phương trình: \(\left\{ \begin{array}{l}{m_{N{a_2}S{O_4}}} + {m_{NaOH\,du}} = {m_Z}\\BT:Na = > 2{n_{N{a_2}S{O_4}}} + {n_{NaOHdu}} = {n_{NaOH\,bd}}\end{array} \right. \Rightarrow \left\{ \begin{array}{l}142a + 40b = 60,8\\2a + b = 0,9\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = 0,4\\b = 0,1\end{array} \right.\)
BTNT “S”: nH2SO4 bđ = nSO2 + nNa2SO4
⟹ 0,6 = nSO2 + 0,4
⟹ nSO2 = 0,6 – 0,4 = 0,2 (mol)
BT e ta có: nCu = nSO2 = 0,2 (mol) (Do Cu từ số oxh 0 lên +2, còn S từ số oxi hóa +6 xuống +4)
⟹ mCu = 0,2.64 = 12,8 (g)
⟹ mCuO = mA – mCu = 20,8 – 12,8 = 8 (g)
⟹ nCuO = mCuO : MCuO = 8 : 80 = 0,1 (mol)
BTNT “Cu”: nCuSO4 = nCu + nCuO = 0,2 + 0,1 = 0,3 (mol)
⟹ mCuSO4 = nCuSO4×MCuSO4 = 0,3×160 = 48 (g)
Ta có: mA + mdd H2SO4 = mdd X + mSO2
⟹ mdd X = mA + mdd H2SO4 - mSO2 = 20,8 + 73,5 – 0,2.64 = 81,5 (g)
Phần trăm khối lượng CuSO4 có trong dd X là:
\(C\% = \frac{{{m_{CuS{O_4}}}}}{{{m_{dd\,X}}}}.100\% = \frac{{48}}{{81,5}}.100\% = 58,90\% \)
Câu hỏi 29 :
Dẫn V lít khí SO2 (đktc) vào 100 ml dung dịch Ba(OH)2 0,5 M thu được dung dịch A chỉ chứa một chất tan duy nhất và không có khí thoát ra. Thêm tiếp NaOH dư vào dung dịch A thu được m gam kết tủa. Tìm giá trị của V và m.
- A V = 2,24 lít và m = 21,7 gam.
- B V = 2,24 lít và m = 10,85 gam
- C V = 1,12 lít và m = 21,7 gam.
- D V = 1,12 lít và m = 10,85 gam.
Đáp án: B
Phương pháp giải:
- Vì SO2 tác dụng với Ba(OH)2 thu được một chất tan duy nhất và tạo kết tủa khi thêm NaOH nên A chứa Ba(HSO3)2. Không thấy có khí thoát ra nên SO2 hết. Ba(HSO3)2 tác dụng với dung dịch NaOH thu được kết tủa là BaSO3.
- Viết PTHH và tính theo số mol của Ba(OH)2.
Lời giải chi tiết:
100 ml = 0,1 (lít)
nBa(OH)2 = 0,1×0,5 = 0,05 (mol)
2SO2 + Ba(OH)2 → Ba(HSO3)2
(mol) 0,1 ← 0,05 → 0,05
→ VSO2(đktc) = nSO2 × 22,4 = 0,1.22,4 = 2,24 lít
Ba(HSO3)2 + 2NaOH → BaSO3 + Na2SO3 + 2H2O
(mol) 0,1 → 0,1
→ m↓ = mBaSO3 = nBaSO3 × MBaSO3 = 0,05.217 = 10,85 (gam)
