Câu hỏi 1 :
O2 bị lẫn một ít tạp chất Cl2. Chất tốt nhất để loại bỏ Cl2 là
- A
H2O.
- B
KOH.
- C
SO2.
- D
KI.
Đáp án: B
Phương pháp giải:
Cần nắm được tính chất hóa học của clo
Lời giải chi tiết:
Cl2 bị hấp thụ hoàn toàn trong dung dịch KOH => loại bỏ Cl2 bằng KOH
Cl2 + 2KOH → KCl + KClO + H2O
Câu hỏi 2 :
Cho phản ứng: KX rắn + H2SO4 đặc, nóng → K2SO4 + HX khí. KX có thể là
- A
KF, KCl, KBr, KI.
- B
KF, KCl, KBr.
- C
KF và KCl.
- D
KCl.
Đáp án: C
Phương pháp giải:
Xem lại lí thuyết hợp chất không có oxi của halogen
Lời giải chi tiết:
KX có thể là KF và KCl
không thể là KBr và KI vì khí HBr và HI sinh ra phản ứng được với H2SO4 đặc nóng
Câu hỏi 3 :
Để phân biệt các chất rắn Fe và Cu bằng phương pháp hóa học, người ta sử dụng thuốc thử là
- A
dung dịch HNO3 loãng
- B
dung dịch HNO3 đặc
- C
dung dịch H2SO4 loãng
- D
dung dịch H2SO4 đặc
Đáp án: C
Phương pháp giải:
Xem lại tính chất hóa học của H2SO4 loãng
Lời giải chi tiết:
Dung dịch H2SO4 loãng tác dụng được với kim loại hoạt động (đứng trước H trong dãy điện hóa) sinh ra khí H2
Cu đứng sau H trong dãy điện hóa không phản ứng.
Câu hỏi 4 :
Ở điều kiện thường, kim loại nào sau đây phản ứng với bột lưu huỳnh?
- A
Fe
- B
Hg
- C
Cr
- D
Cu
Đáp án: B
Lời giải chi tiết:
Hg là kim loại duy nhất phản ứng với S ở nhiệt độ thường
Hg + S → HgS
Câu hỏi 5 :
Trong các câu sau đây, câu nào sai ?
- A
Khi sục SO2 vào dung dịch NaOH theo tỉ lệ $1 < \frac{{{n_{NaOH}}}}{{{n_{S{O_2}}}}} < 2$ thu được hỗn hợp 2 muối Na2SO3 và NaHSO3.
- B
Sục SO2 vào dung dịch K2CO3 tạo khí CO2.
- C
SO2 vừa có tính oxi hóa, vừa có tính khử.
- D
SO2 làm mất màu dung dịch brom.
Đáp án: B
Phương pháp giải:
Xem lại lí thuyết tính chất hóa học (tính chất của oxit axit và tính oxi hóa - khử) của SO2
Lời giải chi tiết:
Câu sai là: Sục SO2 vào dung dịch K2CO3 tạo khí CO2. SO2 không đẩy được CO2 ra khỏi dung dịch
Câu hỏi 6 :
Dung dịch H2SO4 loãng phản ứng được với tất cả các chất trong dãy nào sau đây?
- A
Al2O3, Ba(OH)2, Ag.
- B
CuO, NaCl, CuS.
- C
FeCl3, MgO, Cu.
- D
BaCl2, Na2CO3, FeS.
Đáp án: D
Phương pháp giải:
Lời giải chi tiết:
A Sai vì Ag không phản ứng.
B Sai vì CuS không phản ứng.
C Sai vì NaCl và CuS không phản ứng.
D Đúng.
PTHH : $BaC{l_2}\,\,\,\, + \,\,\,\,{H_2}S{O_4}\xrightarrow{{}}\,\,BaS{O_4} \downarrow \,\,\, + \,\,\,2HCl$
$N{a_2}C{O_3}\,\,\, + \,\,\,{H_2}S{O_4}\xrightarrow{{}}\,\,N{a_2}S{O_4}\,\,\, + \,\,\,C{O_2} \uparrow \,\,\, + \,\,{H_2}O$
$FeS\,\,\, + \,\,\,\,{H_2}S{O_4}\xrightarrow{{}}FeS{O_4}\,\, + \,\,\,{H_2}S \uparrow $
Câu hỏi 7 :
Hệ số của O2 trong phương trình: H2S + O2 → H2O + SO2 là bao nhiêu?
- A
1
- B
2
- C
3
- D
4
Đáp án: C
Phương pháp giải:
Cân bằng PTHH, sau đó cộng tổng các hệ số
Lời giải chi tiết:
2H2S + 3O2 → 2H2O + 2SO2
=> hệ số của O2 là 3
Câu hỏi 8 :
Khi cho cùng một lượng nhôm vào cốc đựng dung dịch axit HCl 0,1M, tốc độ phản ứng sẽ lớn nhất khi dùng nhôm ở dạng nào sau đây?
- A Dạng viên nhỏ.
- B Dạng bột mịn, khuấy đều.
- C Dạng tấm mỏng.
- D Dạng nhôm dây.
Đáp án: B
Phương pháp giải:
Dựa vào sự ảnh hưởng của diện tích tiếp xúc đến tốc độ của phản ứng.
Lời giải chi tiết:
Diện tích tiếp xúc càng lớn thì phản ứng càng dễ xảy ra => khi Al dạng bột là có diện tích tiếp xúc lớn nhất nên tốc độ phản ứng lớn nhất
Câu hỏi 9 :
Cho phản ứng: Fe2O3(r) + 3CO(k) \( \rightleftarrows \) 2Fe(r) + 3CO2 (k). Khi tăng áp suất của phản ứng này thì
- A cân bằng chuyển dịch theo chiều thuận.
- B cân bằng không bị chuyển dịch.
- C cân bằng chuyển dịch theo chiều nghịch.
- D phản ứng dừng lại.
Đáp án: B
Phương pháp giải:
Áp dụng nguyên lý chuyển dịch cân bằng Lơ Sa-tơ-li-ê: “Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ, thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.’’
Lời giải chi tiết:
Cân bằng có tổng số mol khí hai bên bằng nhau nên sự thay đổi của áp suất không ảnh hưởng đến sự chuyển dịch cân bằng
Câu hỏi 10 :
Tính chất nào dưới đây là tính chất đặc trưng của khí hiđro sunfua ?
- A
Là chất khí không màu.
- B
Là chất khí độc.
- C
Là chất khí có mùi trứng thối.
- D
Cả 3 phương án trên đều đúng.
Đáp án: D
Lời giải chi tiết:
Tính chất đặc trưng của khí hiđro sunfua là chất khí không màu, độc, có mùi trứng thối.
Câu hỏi 11 :
Trong phản ứng Cl2 + 2KI → 2KCl + I2. Clo đóng vai trò là chất gì?
- A
Chất oxi hóa.
- B
Chất khử.
- C
Vừa là chất oxi hóa, vừa là chất khử.
- D
Môi trường.
Đáp án: A
Phương pháp giải:
Viết quá trình trao đổi e của nguyên tố Clo => chất khử cho e, chất oxi hóa nhận e
Lời giải chi tiết:
${{\mathop {Cl}\limits^0}_{2}}$ $+ 2{\text{e}} \to 2\mathop {Cl}\limits^{ - 1} $
=> Clo là chất oxi hóa
Câu hỏi 12 :
Nhận xét nào sau đây về khí hiđro clorua là không đúng?
- A
Là chất khí ở điều kiện thường
- B
Có mùi xốc.
- C
Tan tốt trong nước.
- D
Có tính axit.
Đáp án: D
Lời giải chi tiết:
Nhận xét không đúng là: khí hiđro clorua có tính axit.
Câu hỏi 13 :
Nguyên tố halogen có bán kính nguyên tử lớn nhất là
- A
Clo
- B
Brom
- C
Flo
- D
Iot
Đáp án: D
Lời giải chi tiết:
Bán kính nguyên tử của các nguyên tố nhóm halogen tăng dần theo thứ tự : F < Cl < Br < I=> Nguyên tố có bán kính nguyên tử lớn nhất là: Iot
Câu hỏi 14 :
Để điều chế khí HCl trong công nghiệp, người ta sử dụng phương pháp:
- A
Sunfat.
- B
Tổng hợp.
- C
Clo hoá các hợp chất hữu cơ.
- D
Cả A, B, C đều đúng.
Đáp án: B
Lời giải chi tiết:
Điều chế khí HCl trong công nghiệp bằng phương pháp tổng hợp:
H2 + Cl2 $\xrightarrow{{{t^o}}}$ 2HCl
Câu hỏi 15 :
Axit pecloric có công thức là:
- A
HClO.
- B
HClO2.
- C
HClO3.
- D
HClO4
Đáp án: D
Phương pháp giải:
Xem lại các hợp chất có oxi của Clo
Lời giải chi tiết:
Axit pecloric có công thức là HClO4
Câu hỏi 16 :
Khẳng định nào sai khi nói về CaOCl2
- A
Là chất bột trắng, luôn bốc mùi clo.
- B
Là muối kép của axit hipoclorơ và axit clohidric.
- C
Là chất sát trùng, tẩy trắng sợi vải.
- D
Là muối hỗn tạp của axit hipoclorơ và axit clohiđric.
Đáp án: B
Lời giải chi tiết:
Khẳng định sai: CaOCl2 là muối kép của axit hipoclorơ và axit clohidric.
Lưu ý: CaOCl2 = CaCl2.Ca(ClO)2: được gọi là muối hỗn tạp
(Muối hỗn tạp: muối của một kim loại với nhiều gốc axit khác nhau
Muối kép: muối của nhiều cation khác nhau với một gốc axit)
Câu hỏi 17 :
Trong nhóm halogen, sự biến đổi tính chất nào sau đây của đơn chất đi từ flo đến iot là đúng ?
- A
Ở điều kiện thường, trạng thái tập hợp chuyển từ thể khí sang thể lỏng và rắn
- B
Màu sắc nhạt dần
- C
Nhiệt độ nóng chảy giảm đân
- D
Tính oxi hóa tăng dần
Đáp án: A
Phương pháp giải:
Xem lại lí thuyết halogen
Lời giải chi tiết:
đơn chất đi từ flo đến iot: trạng thái tập hợp chuyển từ thể khí sang thể lỏng và rắn
Câu hỏi 18 :
Cho phản ứng: 2KMnO4 + 5H2O2 + 3H2SO4 → 2MnSO4 + K2SO4 + 5O2 + 8H2O. Hệ số tỉ lượng đúng ứng với chất oxi hoá và chất khử là:
- A
5 và 3
- B
5 và 2
- C
2 và 5
- D
2 và 3
Đáp án: C
Lời giải chi tiết:
Chất oxi hóa là KMnO4 và chất khử là H2O2
=> Hệ số tỉ lượng đúng ứng với chất oxi hoá và chất khử là: 2 và 5
Câu hỏi 19 :
Các khí sinh ra trong thí nghiệm phản ứng của FeCO3 với dung dịch H2SO4 đặc bao gồm
- A
H2S và CO2.
- B
H2S và SO2.
- C
SO2 và SO3
- D
SO2 và CO2.
Đáp án: D
Phương pháp giải:
Xem lại tính chất hóa học của H2SO4 đặc
Lời giải chi tiết:
2FeCO3 + 4H2SO4 đặc → Fe2(SO4)3 + SO2 + 2CO2 + 4H2O
Câu hỏi 20 :
Hỗn hợp khí A gồm clo và oxi. A phản ứng vừa hết với một hỗn hợp gồm 4,8 gam Mg và 8,1 gam Al tạo ra 37,05 gam hỗn hợp các muối clorua và oxit của hai kim loại. Phần trăm theo thể tích của clo trong hỗn hợp ban đầu là:
- A 44,44%.
- B 55,56%.
- C 26,50%.
- D 73,50%.
Đáp án: B
Phương pháp giải:
Bảo toàn khối lượng và bảo toàn electron.
Lời giải chi tiết:
nMg = 0,2 mol và nAl = 0,3 mol
Bảo toàn khối lượng : mAl + mMg + mCl2 + mO2 = mmuối clorua + moxit
=> 8,1 + 4,8 + 71nCl2 + 32nO2 = 37,05 (1)
Các hợp chất sau phản ứng gồm : MgCl2 ; MgO ; Al2O3 ; AlCl3
Bảo toàn electron: 2nCl2 + 4nO2 = 2nMg + 3nAl = 1,3 (2)
Giải (1) và (2) => nCl2 = 0,25 ; nO2 = 0,2 mol
=> %VCl2 = 55,56%
Câu hỏi 21 :
Sục khí clo (Cl2) dư vào dung dịch chứa muối NaBr và KBr thu được muối NaCl và KCl, đồng thời thấy khối lượng muối giảm 4,45 gam so với ban đầu. Lượng clo (Cl2) đã tham gia phản ứng là:
- A
0,1 mol.
- B
0,05 mol.
- C
0,02 mol.
- D
0,01 mol.
Đáp án: B
Phương pháp giải:
Gọi số mol Cl2 phản ứng là x
Tổng quát : Cl2 + 2Br- -> Br2 + 2Cl-
Mol x -> 2x -> 2x
=> mmuối giảm = mBr- - mCl-
Lời giải chi tiết:
Gọi số mol Cl2 phản ứng là x
Tổng quát : Cl2 + 2Br- -> Br2 + 2Cl-
Mol x -> 2x -> 2x
=> mmuối giảm = mBr- - mCl- = 80.2x – 35,5.2x = 4,45
=> x = 0,05 mol
Câu hỏi 22 :
Cho một lượng muối khan BaCl2 tác dụng vừa đủ với 300 gam dung dịch H2SO4 14,7% thu được dung dịch X và kết tủa. Phần trăm chất tan trong dung dịch X là
- A
11,38%.
- B
8,35%.
- C
12,15%.
- D
15,46%.
Đáp án: A
Phương pháp giải:
+) $C\% = \frac{{{m_{ct}}}}{{{m_{{\text{dd}}}}}}.100\% $ → ${m_{{H_2}S{O_4}}}$ → ${n_{{H_2}S{O_4}}}$
PTHH: BaCl2 + H2SO4 → BaSO4 ↓ + 2HCl
=> tính số mol BaSO4, HCl và BaCl2 theo số mol H2SO4
+) mdung dịch spứ = ${m_{BaC{l_2}}} + {m_{{\text{dd}}\,\,{H_2}S{O_4}}} - {m_{BaS{O_4}}}$
+) $C{\% _{HCl}} = \frac{{{m_{HCl}}}}{{{m_{{\text{dd}}}}}} $
Lời giải chi tiết:
$C\% = \frac{{{m_{ct}}}}{{{m_{{\text{dd}}}}}}.100\% $ → ${m_{{H_2}S{O_4}}} = \frac{{{m_{{\text{dd}}}}.C\% }}{{100\% }} = \frac{{300.14,7\% }}{{100\% }} = 44,1\,\,g$ → ${n_{{H_2}S{O_4}}}$ = $\frac{m}{M}$ = 0,45 mol
PTHH: BaCl2 + H2SO4 → BaSO4 ↓ + 2HCl
0,45 ← 0,45 → 0,45 → 0,9
Dung dịch X chứa chất tan HCl: mHCl = n.M = 32,85 g
mdung dịch spứ =${m_{BaC{l_2}}} + {m_{{\text{dd}}\,\,{H_2}S{O_4}}} - {m_{BaS{O_4}}}$ = 0,45.208 + 300 – 0,45.233 = 288,75 g
$C{\% _{HCl}} = \frac{{{m_{HCl}}}}{{{m_{{\text{dd}}}}}} = \frac{{32,85}}{{288,75}} \approx 11,38\% $
Câu hỏi 23 :
Hoà tan hoàn toàn a gam hỗn hợp A gồm Zn và một kim loại M vào dung dịch H2SO4 đặc thu được 4,144 lít hỗn hợp khí X gồm SO2 và H2S có tỉ khối so với hiđro bằng 31,595. Khối lượng axit H2SO4 đặc đã phản ứng là
- A
37,73 gam.
- B
37,24 gam.
- C
39,20 gam.
- D
39,69 gam.
Đáp án: A
Phương pháp giải:
+) ${n_{S{O_2}}} = a\,mol;\,{n_{{H_2}S}} = \,b\,mol$ → PT(1)
+) Từ ${\overline M _X}$ => PT(2)
Xét quá trình nhận e
$\mathop S\limits^{ + 6} \,\,\,\,\,\,\,\, + \,\,\,\,\,\,\,\,2e\,\,\,\,\,\, \to \,\,\,\mathop S\limits^{ + 4} $
$\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,36\,\, \leftarrow \,\,0,18$
$\mathop S\limits^{ + 6} \,\,\,\,\,\,\,\, + \,\,\,\,\,\,\,\,8e\,\,\,\,\,\, \to \,\,\,\mathop S\limits^{ - 2} $
$\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,04\,\,\,\, \leftarrow \,\,\,0,005$
+) ne nhận = ne cho => tính ne cho
+) ${n_{{H_2}S{O_4}}} = {n_{SO_4^{2 - }}} + {n_{S{O_2}}}+{n_{{H_2}S}}$
Lời giải chi tiết:
+) ${n_{S{O_2}}} = a\,mol;\,{n_{{H_2}S}} = b\,mol$
nX = $\frac{{4,144}}{{22,4}}$ = 0,185 mol → a + b = 0,185 (1)
+) ${\overline M _X} = {\kern 1pt} \frac{{64a+ 34b}}{{a+ b}}= 2.31,595$ → 0,81a = 29,19b (2)
Từ (1) và (2) → a = 0,18; b = 0,005
Xét quá trình nhận e
$\mathop S\limits^{ + 6} \,\,\,\,\,\,\,\, + \,\,\,\,\,\,\,\,2e\,\,\,\,\,\, \to \,\,\,\mathop S\limits^{ + 4} $
$\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,36\,\, \leftarrow \,\,0,18$
$\mathop S\limits^{ + 6} \,\,\,\,\,\,\,\, + \,\,\,\,\,\,\,\,8e\,\,\,\,\,\, \to \,\,\,\mathop S\limits^{ - 2} $
$\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,04\,\,\,\, \leftarrow \,\,\,0,005$
→ ne nhận = 0,36 + 0,04 = 0,4 mol → ne cho = 0,4 mol
+) ${n_{{H_2}S{O_4}}} = {n_{SO_4^{2 - }}} + {n_{S{O_2}}} + {n_{{H_2}S}} = \frac{{{n_{e\,cho}}}}{2}+ 0,18+ 0,005$= 0,385 mol
→${m_{{H_2}S{O_4}}}$ = 0,385.98 = 37,73 gam
Câu hỏi 24 :
Hòa tan kim loại Fe vào dung dịch H2SO4 đặc, nóng đến khi phản ứng xảy ra hoàn toàn thu được dung dịch Y, chất rắn Z và khí T. Phát biểu nào sau đây không đúng
- A
Y chứa Fe2(SO4)3
- B
Z là Fe
- C
T là SO2
- D
Y chứa FeSO4
Đáp án: A
Phương pháp giải:
Xem lại tính chất hóa học của H2SO4 đặc
Lời giải chi tiết:
2Fe + 6H2SO4 đặc → Fe2(SO4)3 + 3SO2 + 6H2O
Fe + Fe2(SO4)3→ 3FeSO4
Y chứa FeSO4; Z chứa Fe dư; khí T là SO2
Phát biểu không đúng là A
Câu hỏi 25 :
Hòa tan hết 1,69 gam oleum có công thức H2SO4.3SO3 vào nước dư. Trung hòa dung dịch thu được cần V ml dung dịch KOH 1M. Giá trị của V là
- A
10.
- B
40.
- C
20.
- D
30.
Đáp án: B
Phương pháp giải:
+) Bảo toàn nguyên tố S: ${{n}_{{{H}_{2}}S{{O}_{4}}}}=4.{{n}_{{{H}_{2}}S{{O}_{4}}.3S{{O}_{3}}}}$
+) tính số mol KOH theo PT: 2KOH + H2SO4 → K2SO4 + H2O
Lời giải chi tiết:
Số mol oleum : ${{n}_{{{H}_{2}}S{{O}_{4}}.3\text{S}{{O}_{3}}}}=\frac{1,69}{338}=0,005\,mol$
Bảo toàn nguyên tố S: ${{n}_{{{H}_{2}}S{{O}_{4}}}}=4.{{n}_{{{H}_{2}}S{{O}_{4}}.3S{{O}_{3}}}}=4.0,005=0,02\,mol$
2KOH + H2SO4 → K2SO4 + H2O
0,04 mol ← 0,02mol
=> Thể tích dung dịch KOH cần dùng là: VKOH = 0,04 lít = 40 ml
Câu hỏi 26 :
Phản ứng trong bình kín giữa các phân tử khí xảy ra theo phương trình:
A2 + 2B → 2AB
Tốc độ của phản ứng thay đổi như thế nào khi áp suất của A2 tăng lên 6 lần?
- A
Tăng lên 6 lần.
- B
Giảm đi 6 lần.
- C
Tăng lên 36 lần.
- D
Giảm đi 36 lần.
Đáp án: A
Phương pháp giải:
Công thức tính tốc độ phản ứng theo k: ${v_1} = k\left[ {{A_2}} \right]{\left( {\left[ B \right]} \right)^2}$
Lời giải chi tiết:
Gọi k là hằng số tốc độ phản ứng.
→ Công thức tính tốc độ phản ứng theo k: ${v_1} = k\left[ {{A_2}} \right]{\left( {\left[ B \right]} \right)^2}$
Khi áp suất của A2 tăng lên 6 lần thì nồng độ của A2 tăng lên 6 lần và nồng độ của B không đổi thì: ${v_2}{\text{ }} = k.6.\left[ {{A_2}} \right]{\left( {\left[ B \right]} \right)^2}$
$\to \,\,\frac{{{v_2}}}{{{v_1}}} = \,\,\frac{{k.6.\left[ {{A_2}} \right]{{\left( {\left[ B \right]} \right)}^2}}}{{k\left[ {{A_2}} \right]{{\left( {\left[ B \right]} \right)}^2}}}\,\, = \,\,6\,\, \to \,\,{v_2} = \,\,6{v_1}$ → Tốc độ phản ứng tăng lên 6 lần.
Câu hỏi 27 :
Dưới tác dụng của nhiệt, PCl5 bị phân tách thành PCl3 và Cl2 theo phản ứng cân bằng PCl5(k) \( \rightleftarrows \) PCl3(k) + Cl2(k). Ở 2730C và dưới áp suất 1atm, hỗn hợp lúc cân bằng có khối lượng riêng là 2,48 gam/lít. Lúc cân bằng nồng độ mol của PCl5 có giá trị gần nhất với ?
- A 0,75.10-3
- B 1,39.10-3
- C 1,45.10-3
- D 1,98.10-3
Đáp án: C
Phương pháp giải:
Tính theo cân bằng hóa học: PCl5 \( \rightleftarrows \) PCl3 + Cl2
Lời giải chi tiết:
Xét 1 lit hỗn hợp khí => nhh = 0,0223 mol
PCl5 \( \rightleftarrows \) PCl3 + Cl2
x y y (mol)
=> mhh = 208,5(x + y) = 2,48g => x + y = 0,0119 mol
nhh khí = x + 2y = 0,0223 mol
=> x = 1,5.10-3 ; y = 0,0104 mol
Câu hỏi 28 :
Nguyên tố R là phi kim thuộc phân nhóm chính trong bảng tuần hoàn. Tỉ lệ giữa phần trăm nguyên tố R trong oxit cao nhất và phần trăm R trong hợp chất khí với hiđro bằng 0,5955. Cho 4,05 gam một kim loại M chưa rõ hóa trị tác dụng hết với đơn chất R thì thu được 40,05 gam muối. Xác định công thức của muối M.
- A AlCl3.
- B AlBr3.
- C ZnCl2.
- D
ZnBr2
Đáp án: B
Phương pháp giải:
Đặt công thức oxi cao nhất của R với oxi là R2Ox (với x - số thứ tự nhóm của R trong BTH)
→ Hóa trị của R với hidro là: 8 - x
→ Công thức của X với hợp chất hidro là RH8-x
Theo bài ta suy ra
\( \Rightarrow \frac{{\frac{{2{M_R}}}{{2{M_R} + 16x}}.100\% }}{{\frac{{{M_R}}}{{{M_R} + (8 - x)}}.100\% }} = 0,5955 \Rightarrow phuong\,trinh\,moi\,quan\,he\,giua\,{M_{R\,}}va\,x\).
Chạy giá trị x từ 1đến 7 sẽ tìm được MR thỏa mãn.
Lời giải chi tiết:
Đặt công thức oxi cao nhất của R với oxi là R2Ox (với x - số thứ tự nhóm của R trong BTH)
→ Hóa trị của R với hidro là: 8 - x
→ Công thức của X với hợp chất hidro là RH8-x
Phần trăm của R trong R2Ox là: \(\% R = \frac{{2{M_R}}}{{2{M_R} + 16x}}.100\% \)
Phần trăm của R trong RH8-x là: \(\% R = \frac{{{M_R}}}{{{M_R} + (8 - x)}}.100\% \)
Theo bài ta suy ra
\(\begin{array}{l} \Rightarrow \frac{{\frac{{2{M_R}}}{{2{M_R} + 16x}}.100\% }}{{\frac{{{M_R}}}{{{M_R} + (8 - x)}}.100\% }} = 0,5955\\ \Rightarrow \frac{{2{\rm{[}}{M_R} + (8 - x){\rm{]}}}}{{2{M_R} + 16x}} = 0,5955\\ \Rightarrow 2{M_R} + 16 - 2x = 1,191.{M_R} + 9,528x\\ \Rightarrow 0,809{M_R} = 11,528x - 16\end{array}\)
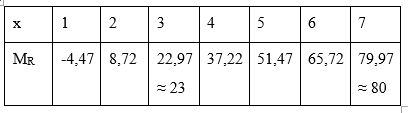
Vậy với x = 7 thì MR = 80 thỏa mãn → R là Brom
Đặt hóa trị của kim loại M là n
PTHH: 2M + nBr2 \(\buildrel {{t^0}} \over\longrightarrow \)2MBrn
Theo PT có: nM = nMBrn
\(\begin{array}{l} \Rightarrow \frac{{4,05}}{M} = \frac{{40,05}}{{M + 80n}}\\ \Rightarrow 4,05M + 324n = 40,05M\\ \Rightarrow 36M = 324n\\ \Rightarrow M = 9n\end{array}\)
Hóa trị của kim loại thường là 1,2, 3. Chạy n = 3 thì M = 27 thỏa mãn → M là Nhôm (Al)
Vậy công thức muối là AlBr3.
Câu hỏi 29 :
Hòa tan hết một lượng rắn X gồm FeS; FeS2 và Fe3O4 trong HNO3 dư thấy có 0,34 mol HNO3 phản ứng. Sau phản ứng thu được 5,6 lít (đktc) hỗn hợp NO, NO2 có tỉ khối so với H2 là 15,32 và dung dịch chỉ chứa HNO3 dư cùng 19,26 gam hỗn hợp muối. Biết chỉ xảy ra 2 quá trình khử N+5. Phần trăm khối lượng FeS2 trong X là
- A
42,06%
- B
53,33%
- C
28,57%
- D
42,42%
Đáp án: A
Phương pháp giải:
Đặt a, b, c là số mol FeS, FeS2, Fe3O4
+) Bảo toàn electron: $9.{{n}_{F\text{e}S}}+15.{{n}_{F\text{e}{{S}_{2}}}}+{{n}_{F{{\text{e}}_{3}}{{O}_{4}}}}=3.{{n}_{NO}}+{{n}_{N{{O}_{2}}}}$
=> PT (1)
+) Bảo toàn điện tích: $3.{{n}_{F{{\text{e}}^{3+}}}}=2.{{n}_{SO_{4}^{2-}}}+{{n}_{NO_{3}^{-}}}$
=> PT (2)
+) Khối lượng muối => PT (3)
Lời giải chi tiết:
nNO = 0,24 mol; nNO2 = 0,01 mol
Đặt a, b, c là số mol FeS, FeS2, Fe3O4
Xét quá trình cho – nhận e:
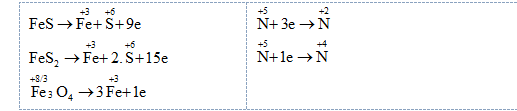
Bảo toàn electron: $9.{{n}_{F\text{e}S}}+15.{{n}_{F\text{e}{{S}_{2}}}}+{{n}_{F{{\text{e}}_{3}}{{O}_{4}}}}=3.{{n}_{NO}}+{{n}_{N{{O}_{2}}}}$
=> 9a + 15b + c = 0,24.3 + 0,01.1 (1)
Dung dịch sau phản ứng chứa:
Fe3+ : (a + b + 3c) mol
SO42- : (a + 2b) mol
NO3- : 0,34 – 0,24 – 0,01 = 0,09 mol (BTNT N)
Bảo toàn điện tích: $3.{{n}_{F{{\text{e}}^{3+}}}}=2.{{n}_{SO_{4}^{2-}}}+{{n}_{NO_{3}^{-}}}$
=> 3.(a + b + 3c) = 2.(a + 2b) + 0,09 (2)
mmuối = 56.(a + b + 3c) + 96.(a + 2b) + 62.0,09 = 19,26 (3)
Từ (1), (2), (3) => a = 0,03 ; b = 0,03 ; c = 0,01
=> mhh X = 8,56 gam
=> %mFeS2 = 42,06%
Câu hỏi 30 :
Hòa tan m gam hỗn hợp X gồm MgCl2 và FeCl3 vào nước thu được dung dịch Y. Cho dung dịch Y tác dụng với dung dịch NaOH dư thu được m1 gam kết tủa. Cho dung dịch Y tác dụng với dung dịch AgNO3 thu được m2 gam kết tủa. Biết m2 – m1 = 66,7 và tổng số mol muối trong hỗn hợp X là 0,25 mol. Phần trăm khối lượng MgCl2 trong hỗn hợp X là
- A
35,05%.
- B
46,72%.
- C
28,04%.
- D
50,96%.
Đáp án: B
Phương pháp giải:
+) Gọi số mol mỗi muối trong X là a, b
+) Từ tổng số mol X => PT (1)
+) Áp dụng BTNT => Tính số mol kết tủa
+) Từ m2 – m1 = 66,7 => thay bằng ẩn a, b => PT (2)
(1), (2) => a, b
Lời giải chi tiết:
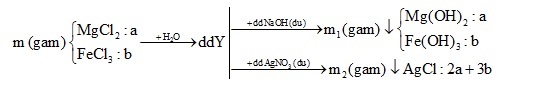
$\Rightarrow \%{{m}_{MgC{{l}_{2}}}}=\frac{0,15.95}{0,15.95+0,1.162,5}.100\%=46,72\%$
