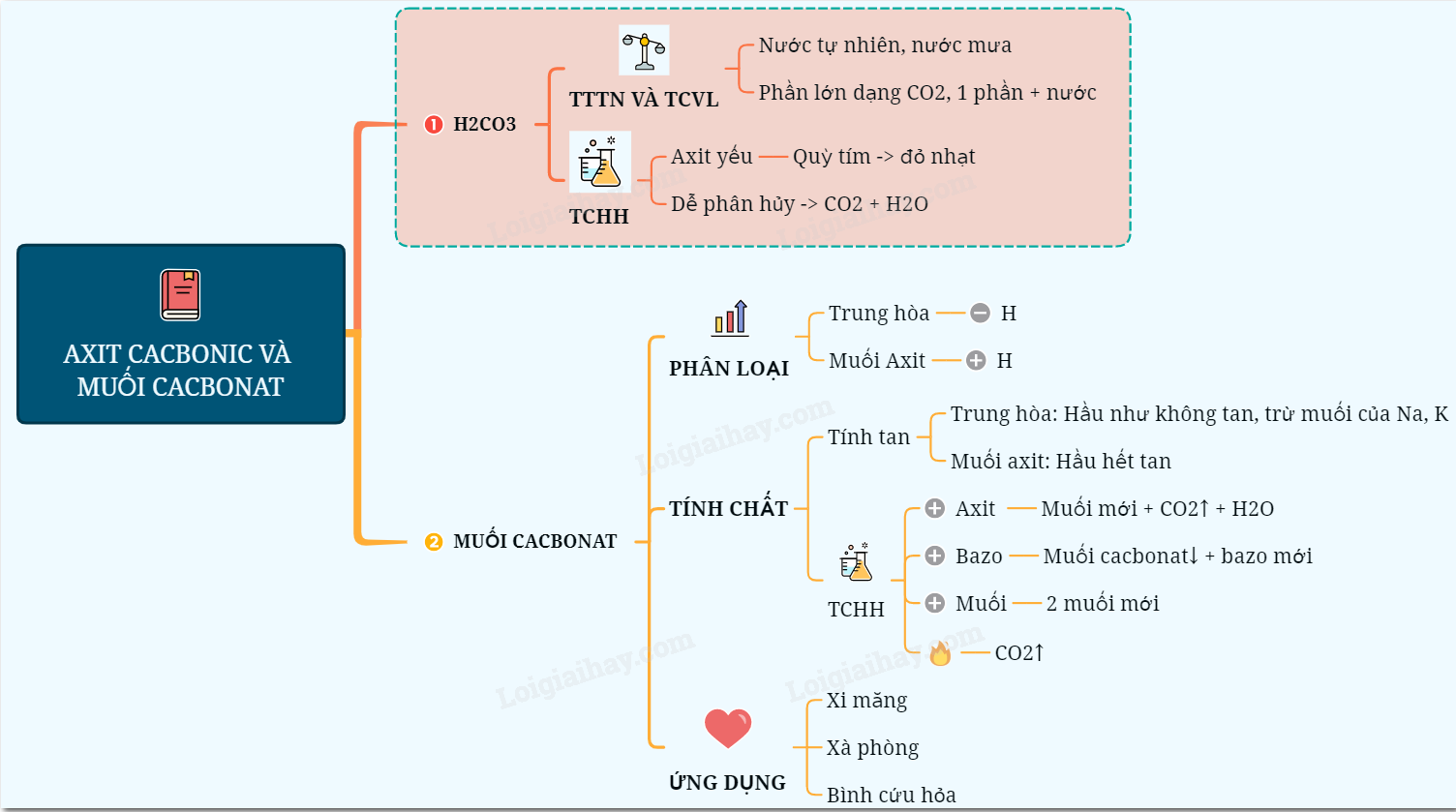
I. AXIT CACBONIC (H2CO3)
1. Trạng thái tự nhiên và tính chất vật lí
- Trong nước tự nhiên và nước mưa có hòa tan khí cacbonic: 1000m3 nước hòa tan được 90 m3 khí CO2.
- Một phần khí CO2 tác dụng với nước tạo thành dung dịch axit cacbonic, phần lớn vẫn tồn tại ở dạng phân tử CO2
2. Tính chất hóa học
- H2CO3 là một axit yếu, dung dịch H2CO3 chỉ làm quỳ tím chuyển thành màu đỏ nhạt, bị axit mạnh đẩy ra khỏi muối.
- H2CO3 là một axit không bền: H2CO3 tạo thành trong các phản ứng hóa học bị phân hủy ngay thành CO2 và H2O.
II. MUỐI CACBONAT
1. Phân loại:
- Muối trung hòa: Không còn nguyên tố H trong thành phần gốc axit.
Thí dụ: Na2CO3, CaCO3,..
- Muối axit: Có nguyên tố H trong thành phần gốc axit.
Thí dụ: NaHCO3, Ca(HCO3)2...
2. Tính chất
- Tính tan: Chỉ có một số muối cacbonat tan được, như Na2CO3, K2CO3... và muối axit như Ca(HCO3)2,...
- Hầu hết muối cacbonat trung hòa không tan, như CaCO3, BaC03, MgC03...
3. Tính chất hóa học
- Muối cacbonat + dd axit mạnh hơn (HCl, HNO3, H,SO4,...) → muối mới + CO2.
Phương trình hóa học:
NaHCO3 + HCl -> NaCl + CO2 + H2O
- Một số dung dịch muối cacbonat + dung dịch bazơ → muối mới + bazơ mới.
Phương trình hóa học:
K2CO3 + Ca(OH)2 -> 2KOH + CaC03
- Dung dịch muối cacbonat + một số dung dịch muối → 2 muối mới
Phương trình hóa học:
Na2CO3 + CaCl2 -> 2NaCl + CaCO3
- Nhiều muối cacbonat (trừ Na2CO3, K,CO3,... )dễ bị nhiệt phân hủy giải phóng khí CO2
Phương trình hóa học:
CaCO3 \( \xrightarrow[]{t^{0}}\) CaO + CO2
4. Ứng dụng:
- CaCO3 là thành phần chính của đá vôi, được dùng để sản xuất vôi, xi măngr..
- Na2CO3 được dùng để nấu xà phòng, sản xuất thủy tinh,..
- NaHCO3 được dùng làm dược phẩm, hóa chất trong bình cứu hỏa,...
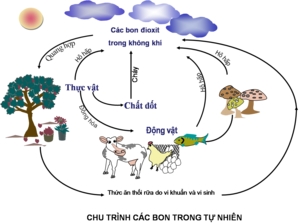
III. CHU TRÌNH CACBON TRONG TỰ NHIÊN
- Hô hấp của động vật, thực vật, đốt cháy thực vật, các thức ăn bị thối rữa do vi khuẩn và vi sinh…tạo ra lượng lớn CO2 trong khí quyển.
- Cây xanh quang hợp lấy CO2 trong khí quyển để tổng hợp diệp lục.
Sơ đồ tư duy: Axit cacbonic và muối cacbonat