- Công thức phân tử C6H6
- Phân tử khối 78
I. TÍNH CHẤT VẬT LÍ
- Benzen C6H6 là chất lỏng, không màu, không tan trong nước, nhẹ hơn nước
- Benzen hòa tan nhiều chất như: dầu ăn, cao su, nến, iot,...
- Benzen độc
II. CẤU TẠO PHÂN TỬ
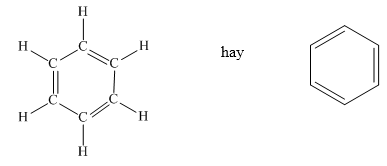
Từ công thức cấu tạo của benzen, ta thấy sáu nguyên tử cacbon liên kết với nhau tạo thành vòng sáu cạnh đều, có ba liên kết đôi xen kẽ ba liên kết đơn.
III. TÍNH CHẤT HÓA HỌC
1. Tác dụng với oxi
- Khi đốt benzen cháy trong không khí tạo ra CO2 và H2O, ngọn lửa có nhiều khói đen (muội than)
C6H6 + $\frac{15}{2}$O2 $\xrightarrow{{{t}^{o}}}$ 6CO2 + 3H2O
- Muội than sinh ra là do trong không khí không cung cấp đủ oxi để đốt cháy hoàn toàn C6H6
2. Phản ứng thế với với brom
- Benzen không làm mất màu dung dịch brom như etilen và axetilen. Nó chỉ tham gia phản ứng thế với brom lỏng và cần có xúc tác là bột sắt.
C6H6 + Br2 $\xrightarrow{F\text{e}}$ HBr + C6H5Br (brombezen)
Benzen chỉ phản ứng với brom nguyên chất, không phản ứng với dung dịch nước brom hay benzen không làm mất màu dung dịch brom ở điều kiện thường.
3. Phản ứng cộng:
- Benzen khó tham gia phản ứng cộng hơn etilen và axetilen. Tuy nhiên, trong điều kiện thích hợp benzen có phản ứng cộng với một số chất như H2, Cl2,…
C6H6 + 3H2 $\xrightarrow{xt,{{t}^{o}}}$ C6H12
C6H6 + 3Cl2 $\xrightarrow{as}$ C6H6Cl6
(Hexacloxiclohexan)
Thuốc trừ sâu 6,6,6
- Do phân tử có cấu tạo đặc biệt nên benzen vừa có phản ứng thế, vừa có phản ứng cộng. Tuy nhiên phản ứng cộng của benzen xảy ra khó hơn etilen và axetilen.
IV. ỨNG DỤNG
- Benzen là nguyên liệu quan trọng để sản xuất chất dẻo, phẩm nhuộm, dược phẩm, thuốc trừ sâu..
- Benzen làm dung môi hòa tan nhiều chất hữu cơ trong công nghiệp và trong phòng thí nghiệm.
Sơ đồ tư duy: Benzen

