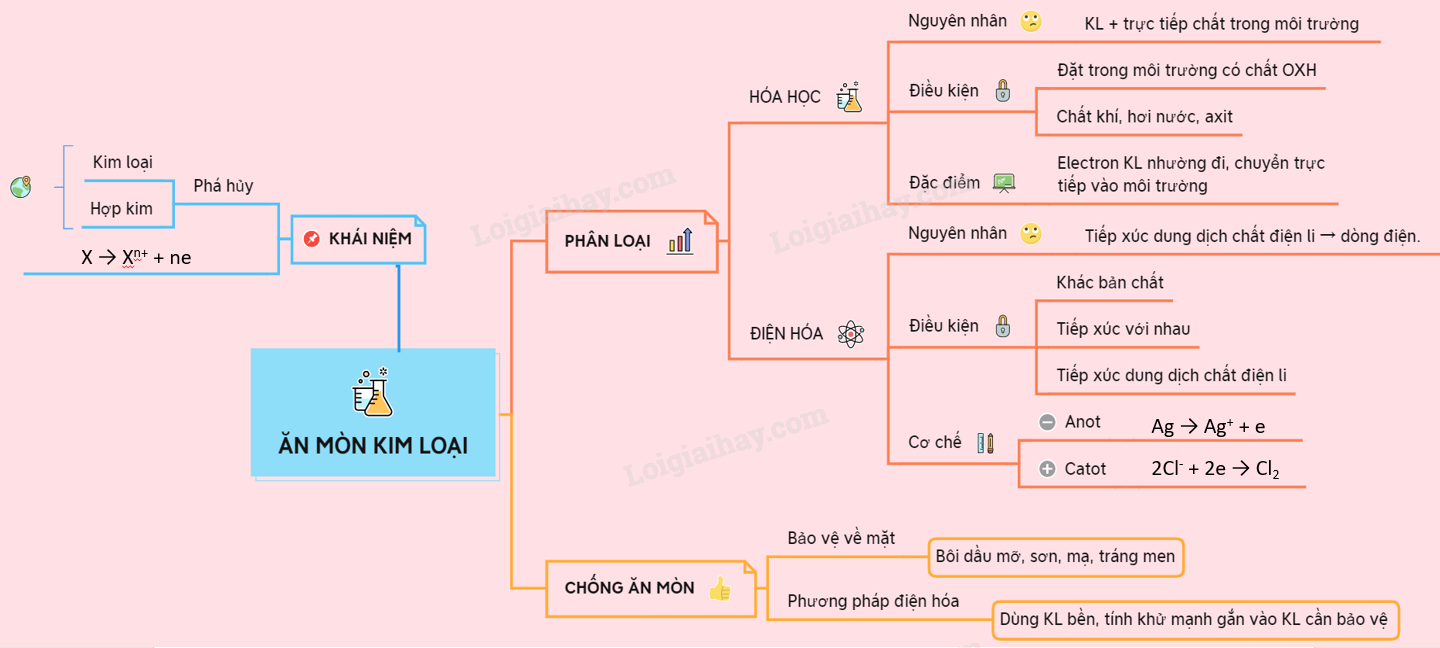
I. KHÁI NIỆM
Ăn mòn kim loại là sự phá hủy kim loại hoặc hợp kim dưới tác dụng của môi trường xung quanh :
X → Xn+ + ne
II. PHÂN LOẠI
1. Ăn mòn hóa học
- Nguyên nhân: do kim loại có phản ứng hóa học trực tiếp với các chất ở môi trường xung quanh.
- Điều kiện: Kim loại được đặt trong môi trường có chứa chất OXH mà kim loại có thể tham gia phản ứng thường là chất khí, hơi nước, dung dịch axit
- Đặc điểm: Đối với ăn mòn hóa học, electron mà kim loại nhường đi được chuyển trực tiếp vào môi trường.
VD: Để sắt ngoài không khí sau một thời gian sắt sẽ bị OXH thành gỉ sắt.
2. Ăn mòn điện hóa
- Là sự phá hủy kim loại hoặc hợp kim do tiếp xúc với dung dịch chất điện li tạo nên dòng điện.
- Điều kiện:
+ Có 2 điện cực khác nhau về bản chất (kim loại + kim loại; kim loại + phi kim; kim loại hợp chất).
+ 2 điện cực phải được tiếp xúc điện với nhau.
+ 2 điện cực cùng được tiếp xúc với dung dịch chất điện li (không khí ẩm).
- Cơ chế của ăn mòn điện hóa
|
Cực âm (Anot) |
Cực dương (Catot) |
|
Xảy ra quá trình OXH – KL bị ăn mòn M → Mn+ + ne |
Xảy ra quá trình Khử - Môi trường bị khử 2Cl- + 2e → Cl2 |
- Đặc điểm: Đối với ăn mòn điện hóa, electron mà kim loại nhường đi được chuyển từ cực của KL có tính khử mạnh sang cực KL có tính khử yếu rồi vào môi trường.
III. CHỐNG ĂN MÒN KIM LOẠI
1. Phương pháp bảo vệ bề mặt
- Dùng chất bền với môi trường để phủ lên bề mặt KL : bôi dầu mỡ, sơn, mạ, tráng men,
- Dùng chất kìm hãm, tăng khả năng chịu đựng với môi trường: hợp kim chống gỉ
VD: sắt tây là sắt được tráng thiếc, tôn là sắt được tráng kẽm.
2. Phương pháp điện hóa
- Dùng kim loại bền có tính khử mạnh hơn gắn vào kim loại cần bảo vệ để làm vật thay thế.
VD: Để bảo vệ vỏ tàu biển bằng thép (thành phần chính là Fe), người ta gắn các lá Zn vào phía ngoài vỏ tàu ở phần chìm trong nước biển
=> Phần vỏ tàu bằng thép là cực dương, các lá Zn là cực âm.
=> Zn là vật hi sinh nên bị ăn mòn. Sau một thời gian nhất định, người ta thay những lá Zn bị ăn mòn bằng những lá Zn khác.
Sơ đồ tư duy: Sự ăn mòn kim loại
soanvan.me
