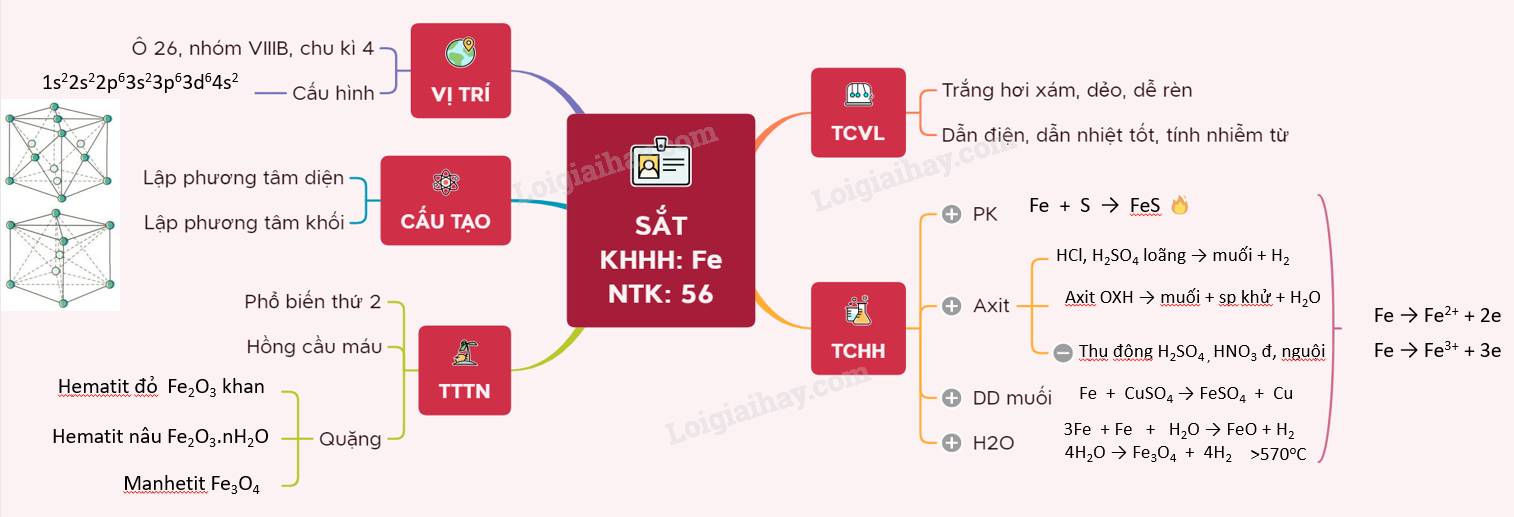
I. VỊ TRÍ VÀ CẤU TẠO
- Fe: Z = 26 1s22s22p63s23p63d64s2
=> Sắt nằm ở chu kì 4, nhóm VIIIB, ô số 26.
- Là kim loại chuyển tiếp, có xu hướng nhường 2, 3 electron khi tham gia phản ứng hóa học
- Sắt có 2 kiểu mạng tinh thể là lập phương tâm diện và lập phương tâm khối
II. TÍNH CHẤT VẬT LÍ
- Sắt là kim loại có màu trắng hơi xám, dẻo, dễ rèn, nóng chảy ở nhiệt độ 1540oC, có D = 7,9 g/cm3.
- Sắt có tính dẫn điện, dẫn nhiệt tốt, đặc biệt có tính nhiễm từ.
III. TÍNH CHẤT HÓA HỌC
1. Tác dụng với phi kim
Fe + S \(\xrightarrow{{{t}^{o}}}\) FeS
3Fe + 2O2 \(\xrightarrow{{{t}^{o}}}\) Fe3O4
2Fe + 3Cl2 \(\xrightarrow{{{t}^{o}}}\) 2FeCl3
2. Tác dụng với axit
- Fe + axit HCl, H2SO4 loãng → muối + H2
Fe + H2SO4 → FeSO4 + H2
- Fe + axit có tính OXH mạnh → muối + sản phẩm khử + H2O
Fe + 4HNO3 → Fe(NO3)3 + 2H2O + NO
2Fe + 6H2SO4 → Fe2(SO4)3 + 6H2O + 3SO2
=> Fe thụ động trong HNO3 đặc nguội, H2SO4 đặc nguội.
3. Tác dụng với dung dịch muối
Fe tác dụng với dung dịch muối của kim loại yếu hơn nó (kim loại đứng sau nó trong dãy hoạt động hóa học)
Fe + CuSO4 → FeSO4 + Cu
Fe + 3AgNO3 (dư) → Fe(NO3)3 + 3Ag
4. Tác dụng với nước
Ở nhiệt độ cao, sắt khử được hơi nước :
3Fe + 4H2O \(\xrightarrow{{{t}^{o}}<{{570}^{o}}C}\) Fe3O4 + 4H2
Fe + H2O \(\xrightarrow{{{t}^{o}}>{{570}^{o}}C}\) FeO + H2
IV. TRẠNG THÁI TỰ NHIÊN
- Sắt là nguyên tố phổ biến thứ 2 trong vỏ trái đất (sau nhôm).
- Một số quặng sắt quan trọng: Quặng hematit đỏ chứa Fe2O3 khan. Quặng hematit nâu chứa Fe2O3.nH2O. Quặng manhetit chứa Fe3O4 , quặng xiđerit chứa FeCO3, quặng pirit sắt chứa FeS2.
- Sắt còn có mặt trong hồng cầu của máu.
Sơ đồ tư duy: Sắt - Fe
soanvan.me
