4.1
Theo mô hình nguyên tử Rutherford - Bohr, vị trí nào trong số các vị trí A, B, C, D trong hình sau mà electron không xuất hiện?
A. Vị trí A.
B. Vị trí B.
C. Vị trí C.
D. Vị trí D.
Phương pháp giải:
Dựa vào đặc điểm mô hình nguyên tử Rutherford - Bohr: các electron chuyển động trên những quỹ đạo tròn hay bầu dục xác định xung quanh hạt nhân
Lời giải chi tiết:
- Đáp án: C
4.2
Lớp electron thứ 3 có bao nhiêu phân lớp?
A. 1.
B. 2.
C. 3.
D. 4.
Phương pháp giải:
Dựa vào số phân lớp trong một lớp electron:
- 4 lớp đầu (1, 2, 3, 4) có số phân lớp trong mỗi lớp bằng số thứ tự của lớp đó
- 3 lớp sau (5, 6, 7) đều có 4 phân lớp
Lời giải chi tiết:
- Đáp án: C
4.3
Phát biểu nào sao đây đúng?
A. Số phân lớp electron có trong lớp N là 4.
B. Số phân lớp electron có trong lớp M là 4
C. Số orbital có trong lớp N là 9.
D. Số orbital có trong lớp M là 8.
Phương pháp giải:
Dựa vào
- Số phân lớp trong một lớp electron:
+ 4 lớp đầu (1, 2, 3, 4) có số phân lớp trong mỗi lớp bằng số thứ tự của lớp đó
+ 3 lớp sau (5, 6, 7) đều có 4 phân lớp
- Cách gọi tên và đánh số các lớp
- Các phân lớp s, p, d, f lần lượt có số AO (Atomic Orbital) tương ứng là 1, 3, 5, 7
Lời giải chi tiết:
- Đáp án: A
- Giải thích:
+ Lớp N có thứ tự là 4 nên có 4 phân lớp electron
+ Lớp M có thứ tự là 3 nên có 3 phân lớp electron
+ Lớp N có 4 phân lớp s, p, d, f nên có tổng cộng 1 + 3 + 5 + 7 = 16 AO
+ Lớp M có 3 phân lớp s, p, d nên có tổng cộng 1 + 3 + 5 = 9 AO
4.4
Phát biểu nào sau đây đúng?
A. Lớp K là lớp xa hạt nhân nhất.
B. Các electron trong cùng một lớp có mức năng lượng bằng nhau.
C. Các electron trên cùng phân lớp có mức năng lượng bằng nhau.
D. Lớp N có 4 orbital.
Phương pháp giải:
Dựa vào đặc điểm của electron, phân lớp và lớp electron:
- Lớp K (lớp 1) là lớp gần hạt nhân nhất
- Các electron trong cùng một lớp có mức năng lượng gần bằng nhau
- Các electron trên cùng phân lớp có mức năng lượng bằng nhau
- Lớp N có 4 phân lớp s, p, d, f nên có tổng cộng 1 + 3 + 5 + 7 = 16 AO
Lời giải chi tiết:
- Đáp án: C
4.5
Phát biểu nào đúng khi nói về các orbital trong một phân lớp electron?
A. Có cùng sự định hướng không gian.
B. Có cùng mức năng lượng.
C. Khác nhau về mức năng lượng.
D. Có hình dạng không phụ thuộc vào đặc điểm mỗi phân lớp.
Phương pháp giải:
Dựa vào đặc điểm của các orbital trong một phân lớp electron
- Có sự định hướng không gian khác nhau
- Có cùng mức năng lượng
- Có hình dạng phụ thuộc vào đặc điểm mỗi phân lớp: AO s có dạng hình cầu, AO p có dạng hình số 8 nổi, AO d và f có hình dạng phức tạp
Lời giải chi tiết:
- Đáp án: B
4.6
Phát biểu nào sau đây không đúng?
A. Lớp M có 9 phân lớp.
B. Lớp L có 4 orbital.
C. Phân lớp p có 3 orbital.
D. Năng lượng của electron trên lớp K là thấp nhất.
Phương pháp giải:
Dựa vào
- Số phân lớp trong một lớp electron:
+ 4 lớp đầu (1, 2, 3, 4) có số phân lớp trong mỗi lớp bằng số thứ tự của lớp đó
+ 3 lớp sau (5, 6, 7) đều có 4 phân lớp
- Cách gọi tên và đánh số các lớp
- Các phân lớp s, p, d, f lần lượt có số AO (Atomic Orbital) tương ứng là 1, 3, 5, 7
- Trong nguyên tử, các electron được sắp xếp thành từng lớp và phân lớp theo mức năng lượng từ thấp đến cao
Lời giải chi tiết:
- Đáp án: A
- Giải thích:
+ Lớp M có 3 phân lớp s, p, d
+ Lớp L có 2 phân lớp s, p nên có tổng cộng 1 + 3 = 4 AO
+ Phân lớp p có 3 orbital
+ Năng lượng của electron trên lớp K là thấp nhất vì lớp K có số thứ tự là 1 và các electron được sắp xếp thành từng lớp và phân lớp theo mức năng lượng từ thấp đến cao
4.7
Cấu hình electron nào sau đây viết sai?
A. 1s22s22p5.
B. 1s22s22p63s23p64s1.
C. 1s22s22p63s23p64s24p5.
D. 1s22s22p63s23p63d34s2
Phương pháp giải:
Dựa vào nguyên lí vững bền: Ở trạng thái cơ bản, các electron trong nguyên tử chiếm lần lượt những orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p…
Lời giải chi tiết:
- Đáp án: C
- Giải thích: Electron chưa dược điền trên phân lớp 3d
4.8
Hợp kim cobalt được sử dụng rộng rãi cho các bộ phận động cơ máy bay vì độ bền nhiệt độ cao là một yếu tố quan trọng. Nguyên tử cobalt có cấu hình electron ngoài cùng là 3d74s2. Số hiệu nguyên tử của cobalt là
A. 24.
B. 25.
C. 27.
D. 29.
Phương pháp giải:
- Bước 1: Viết cấu hình electron của nguyên tử cobalt
Vì nguyên tử cobalt có lớp electron ngoài cùng là 3d74s2 " các phân lớp từ 1s đến 3p đã được bão hòa
- Bước 2: Tính tổng số electron trong nguyên tử nguyên tử cobalt
Vì số e = số p = số hiệu nguyên tử Z
Lời giải chi tiết:
- Cấu hình electron của nguyên tố cobalt là: 1s22s22p63s23p63d74s2
- Tổng số electron = 27 = số p = số hiệu nguyên tử Z
=> Đáp án: C
4.9
Nguyên tử Fe có kí hiệu \({}_{26}^{56}Fe\). Cho các phát biểu sau về Fe:
(1) Nguyên tử của nguyên tố Fe có 8 electron ở lớp ngoài cùng.
(2) Nguyên tử của nguyên tố Fe có 30 neutron trong hạt nhân
(3) Fe là một phi kim.
(4) Fe là nguyên tố d.
Trong các phát biểu trên, phát biểu đúng là
A. (1), (2), (3) và (4).
B. (1), (2) và (4).
C. (2) và (4).
D. (2), (3) và (4).
Phương pháp giải:
- Bước 1: Viết cấu hình electron của nguyên tử
+ 1.1. Xác định số electron của nguyên tử
+ 1.2. Các electron được phân bố theo thứ tự các AO có mức năng lượng tăng dần, theo các nguyên lí và quy tắc phân bố electron trong phân tử
+ 1.3. Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron
- Bước 2: Tìm các dữ kiện cần thiết để trả lời câu hỏi
Lời giải chi tiết:
- Nguyên tử Fe có 26 electron
=> Phân mức năng lượng electron: 1s22s22p63s23p64s23d6
=> Cấu hình electron của nguyên tử Fe: 1s22s22p63s23p63d64s2
(1) Nguyên tử của nguyên tố Fe có 8 electron ở lớp ngoài cùng. -> Đúng
(2) Nguyên tử của nguyên tố Fe có 30 neutron trong hạt nhân
=> Đúng vì n = A - p = 56 - 26 = 30 (hạt)
(3) Fe là một phi kim. -> Sai ở “phi kim” sửa thành “kim loại”
(4) Fe là nguyên tố d. -> Đúng vì electron cuối cùng được điền vào phân lớp d
=> Đáp án: B
4.10
Cấu hình electron của nguyên tử nguyên tố X có dạng 1s22s22p63s23p3. Phát biểu nào sau đây là sai?
A. X ở ô số 15 trong bảng tuần hoàn.
B. X là một phi kim.
C. Nguyên tử của nguyên tố X có 9 electron p.
D. Nguyên tử của nguyên tố X có 3 phân lớp electron.
Phương pháp giải:
Dựa vào:
- Số e = số p = ô số thứ tự
- Dự đoán tính kim loại/ phi kim dựa vào số electron lớp ngoài cùng của nguyên tố nhóm A (bao gồm các nguyên tố s và p)
Lời giải chi tiết:
- Đáp án: C
- Sai ở “9 proton” sửa thành “15 proton”
4.11
Cho biết các trường hợp sau đây đã vi phạm nội dung gì của nguyên lí Pauli hoặc quy tắc Hund
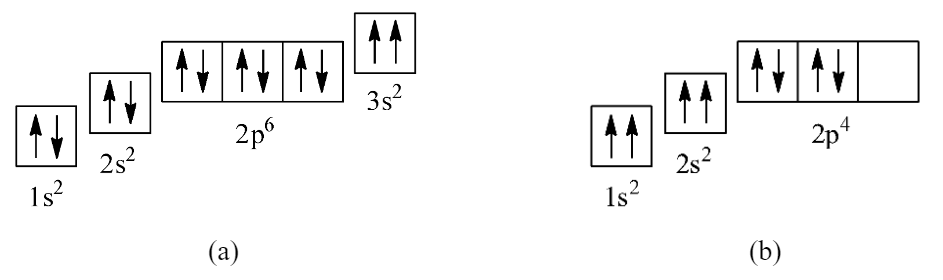
Phương pháp giải:
Dựa vào nội dung của nguyên lí Pauli và quy tắc Hund
- Nguyên lí Pauli: Mỗi orbital chỉ chứa tối đa 2 electron và có chiều tự quay ngược nhau
- Quy tắc Hund: Trong cùng một phân lớp bão hòa, các electron sẽ phân bố vào các orbital sao cho số electron độc thân là tối đa
Lời giải chi tiết:
Các lỗi mắc phải ở 2 cấu hình electron theo ô orbital:
a) - 2 electron của orbital 3s đang cùng chiều với nhau
Sửa lại:
b) - 2 electron của orbital 1s và 2s đang cùng chiều với nhau
- Số electron độc thân trong orbital 2p chưa tối đa
Sửa lại:
4.12
Viết cấu hình electron của nguyên tử các nguyên tố: 6C, 8O, 10Ne, 11Na, 13Al, 17Cl, 29Cu. Hãy cho biết các nguyên tố này là kim loại, phi kim hay khí hiếm.
Phương pháp giải:
- Các bước viết cấu hình electron của nguyên tử
+ Bước 1: Xác định số electron của nguyên tử
+ Bước 2: Các electron được phân bố theo thứ tự các AO có mức năng lượng tăng dần, theo các nguyên lí và quy tắc phân bố electron trong phân tử
+ Bước 3: Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron
- Dự đoán tính kim loại/ phi kim của nguyên tử
Lời giải chi tiết:
- Nguyên tử C có 6 electron
=> Phân mức năng lượng electron: 1s22s22p2
=> Cấu hình electron của nguyên tử C: 1s22s22p2
=> C là nguyên tố nhóm A và có 4 electron ở lớp ngoài cùng nên C là phi kim (dựa theo kiến thức từ lớp trước đã học về C)
- Nguyên tử O có 8 electron
=> Phân mức năng lượng electron: 1s22s22p4
=> Cấu hình electron của nguyên tử O: 1s22s22p4
=> O là nguyên tố nhóm A và có 6 electron ở lớp ngoài cùng nên O là phi kim
- Nguyên tử Ne có 10 electron
=> Phân mức năng lượng electron: 1s22s22p6
=> Cấu hình electron của nguyên tử Ne: 1s22s22p6
=> Ne là nguyên tố nhóm A và có 8 electron ở lớp ngoài cùng nên Ne là khí hiếm
- Nguyên tử Na có 11 electron
=> Phân mức năng lượng electron: 1s22s22p63s1
=> Cấu hình electron của nguyên tử Na: 1s22s22p63s1
=> Na là nguyên tố nhóm A và có 1 electron ở lớp ngoài cùng nên Na là kim loại
- Nguyên tử Al có 13 electron
=> Phân mức năng lượng electron: 1s22s22p63s23p1
=> Cấu hình electron của nguyên tử Al: 1s22s22p63s23p1
=> Al là nguyên tố nhóm A và có 3 electron ở lớp ngoài cùng nên Al là kim loại
- Nguyên tử Cl có 17 electron
=> Phân mức năng lượng electron: 1s22s22p63s23p5
=> Cấu hình electron của nguyên tử Cl: 1s22s22p63s23p5
=> Cl là nguyên tố nhóm A và có 7 electron ở lớp ngoài cùng nên Cl là phi kim
- Nguyên tử Cu có 29 electron
=> Phân mức năng lượng electron: 1s22s22p63s23p64s13d10
=> Cấu hình electron của nguyên tử Cu: 1s22s22p63s23p63d104s1
=> Cu là nguyên tố nhóm B nên Cu là kim loại
4.13
Viết cấu hình electron dưới dạng ô lượng tử của các nguyên tử 12Mg và 24Cr. Hãy cho biết các nguyên tố này là kim loại, phi kim hay khí hiếm.
Phương pháp giải:
Dựa vào
- Các bước viết cấu hình electron của nguyên tử
+ Bước 1: Xác định số electron của nguyên tử
+ Bước 2: Các electron được phân bố theo thứ tự các AO có mức năng lượng tăng dần, theo các nguyên lí và quy tắc phân bố electron trong phân tử
+ Bước 3: Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron
- Viết cấu hình electron dưới dạng ô lượng tử dựa vào:
+ Nguyên lí Pauli: Mỗi orbital chỉ chứa tối đa 2 electron và có chiều tự quay ngược nhau
+ Quy tắc Hund: Trong cùng một phân lớp chưa bão hòa, các electron sẽ phân bố vào các orbital sao cho số electron độc thân là tối đa
- Dự đoán tính kim loại/ phi kim của nguyên tử
Lời giải chi tiết:
- Nguyên tử Mg có 12 electron
=> Phân mức năng lượng electron: 1s22s22p63s2
=> Cấu hình electron của nguyên tử Mg: 1s22s22p63s2
=> Cấu hình electron dưới dạng ô lượng tử
=> Mg là nguyên tố nhóm A và có 2 electron ở lớp ngoài cùng nên Mg là kim loại
- Nguyên tử Cr có 24 electron
=> Phân mức năng lượng electron: 1s22s22p63s23p64s13d5
=> Cấu hình electron của nguyên tử Cr: 1s22s22p63s23p63d54s1
=> Cấu hình electron dưới dạng ô lượng tử:
=> Cr là nguyên tố nhóm B nên Cr là kim loại
4.14
Nguyên tố X được sử dụng rộng rãi để chống đóng băng và khử băng như một chất bảo quản. Nguyên tố Y là nguyên tố thiết yếu cho các cơ thể sống, đồng thời nó được sử dụng nhiều trong việc sản xuất phân bón. Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y có một electron ở lớp ngoài cùng 4s. Nguyên tử X và Y có số electron hơn kém nhau là 3. Nguyên tử X, Y lần lượt là
A. khí hiếm và kim loại.
B. kim loại và khí hiếm.
C. kim loại và kim loại.
D. phi kim và kim loại.
Phương pháp giải:
Dựa vào
- Các bước viết cấu hình electron của nguyên tử
+ Bước 1: Xác định số electron của nguyên tử
+ Bước 2: Các electron được phân bố theo thứ tự các AO có mức năng lượng tăng dần, theo các nguyên lí và quy tắc phân bố electron trong phân tử
+ Bước 3: Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron
- Dự đoán tính kim loại/ phi kim của nguyên tử
Lời giải chi tiết:
- Nguyên tử của nguyên tố Y có 1 electron ở lớp ngoài cùng 4s
=> Cấu hình electron của nguyên tử Y là 1s22s22p63s23p64s1
=> Y là nguyên tố nhóm A và có 1 electron ở lớp ngoài cùng nên Y là kim loại
- Số electron của Y là 19
- Do X và Y hơn kém nhau 3 electron và nguyên tử X có electron ở mức năng lượng cao nhất là 3p " Số electron của X là 16
=> Cấu hình electron của nguyên tử X là 1s22s22p63s23p4
=> X là nguyên tố nhóm A và có 6 electron ở lớp ngoài cùng nên X là phi kim
=> Đáp án: D
4.15
X được dùng làm chất bán dẫn trong kĩ thuật vô tuyến điện, chế tạo pin mặt trời. Nguyên tử của nguyên tố X có 3 lớp electron. Lớp ngoài cùng có 4 electron. Xác định số hiệu nguyên tử của X và tên nguyên tố X. Viết cấu hình electron của X.
Phương pháp giải:
Dựa vào
- Số phân lớp trong một lớp electron:
+ 4 lớp đầu (1, 2, 3, 4) có số phân lớp trong mỗi lớp bằng số thứ tự của lớp đó
+ 3 lớp sau (5, 6, 7) đều có 4 phân lớp
- Số electron tối đa trong mỗi phân lớp electron:

- Các bước viết cấu hình electron của nguyên tử
+ Bước 1: Xác định số electron của nguyên tử
+ Bước 2: Các electron được phân bố theo thứ tự các AO có mức năng lượng tăng dần, theo các nguyên lí và quy tắc phân bố electron trong phân tử
+ Bước 3: Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron
Lời giải chi tiết:
- Nguyên tử của nguyên tố X có 3 lớp electron. Lớp ngoài cùng có 4 electron
=> Cấu hình electron lớp ngoài cùng của nguyên tử X là: 3s23p2
=> Cấu hình electron lớp của nguyên tử X là: 1s22s22p63s23p2
=> Số hiệu nguyên tử của X = số proton = số electron = 14
=> X là nguyên tố Silicon (Si)
4.16
X được dùng để làm vỏ phủ vệ tinh nhân tạo hay khí cầu nhằm tăng nhiệt độ nhờ có tính hấp thụ bức xạ điện từ mặt trời khá tốt. Y là một trong những thành phần đề điều chế nước Javen tẩy trắng quần áo, vải sợi. Nguyên tử của nguyên tố X có tổng số hạt electron trong các phân lớp p là 7. Số hạt mang điện của một nguyên tử Y nhiều hơn số hạt mang điện của một nguyên tử X là 8 hạt. Tìm các nguyên tố X và Y.
Phương pháp giải:
Dựa vào
- Các bước viết cấu hình electron của nguyên tử
+ Bước 1: Xác định số electron của nguyên tử
+ Bước 2: Các electron được phân bố theo thứ tự các AO có mức năng lượng tăng dần, theo các nguyên lí và quy tắc phân bố electron trong phân tử
+ Bước 3: Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron
Lời giải chi tiết:
- Nguyên tử của nguyên tố X có tổng số hạt electron trong các phân lớp p là 7
=> Nguyên tố X có 1 electron ở mức năng lượng cao nhất là 3p
=> Cấu hình electron của nguyên tử X là 1s22s22p63s23p1
=> Tổng số hạt mang điện của nguyên tử X là 13.2 = 26 hạt
- Số hạt mang điện của một nguyên tử Y nhiều hơn số hạt mang điện của một nguyên tử X là 8 hạt -> Y có 26 + 8 = 34 hạt mang điện -> Y có 17 hạt electron
=> Cấu hình electron của nguyên tử Y là 1s22s22p63s23p5
=> Vậy X là nguyên tố Aluminium (Al) và Y là nguyên tố Chlorine (Cl)
4.17
Một nguyên tố mà nguyên tử có 4 lớp electron, có phân lớp d, lớp ngoài cùng đã bão hòa electron. Hãy tính tổng số electron s và electron p của nguyên tố này.
Phương pháp giải:
Dựa vào
- Số phân lớp trong một lớp electron:
+ 4 lớp đầu (1, 2, 3, 4) có số phân lớp trong mỗi lớp bằng số thứ tự của lớp đó
+ 3 lớp sau (5, 6, 7) đều có 4 phân lớp
- Số electron tối đa trong mỗi phân lớp electron:
|
Phân lớp |
s |
p |
d |
f |
|
Số electron tối đa |
2 |
6 |
10 |
14 |
Lời giải chi tiết:
- Nguyên tử có 4 lớp electron, có phân lớp d và phân lớp ngoài cùng đã bão hòa electron
=> Cấu hình electron lớp ngoài cùng của nguyên tử này là 3dx4s2
=> Cấu hình electron của nguyên tử này là 1s22s22p63s23p63dx4s2
=> Tổng số electron s của nguyên tố này = 2 + 2 + 2 + 2 = 8 (electron)
=> Tổng số electron p của nguyên tố này = 6 + 6 = 12 (electron)
4.18
A được dùng để chế tạo đèn có cường độ sáng cao. Nguyên tử A có electron ở phân lớp 3d chỉ bằng một nửa phân lớp 4s. Viết cấu hình electron của nguyên tử A và tên nguyên tố A.
Phương pháp giải:
Dựa vào
- Số phân lớp trong một lớp electron:
+ 4 lớp đầu (1, 2, 3, 4) có số phân lớp trong mỗi lớp bằng số thứ tự của lớp đó
+ 3 lớp sau (5, 6, 7) đều có 4 phân lớp
- Số electron tối đa trong mỗi phân lớp electron:
|
Phân lớp |
s |
p |
d |
f |
|
Số electron tối đa |
2 |
6 |
10 |
14 |
Lời giải chi tiết:
- Nguyên tử A có electron ở phân lớp 3d chỉ bằng một nửa phân lớp 4s
=> Phân lớp 4s có 2 electron và phân lớp 3d có 1 electron
=> Cấu hình electron của nguyên tử A là 1s22s22p63s23p63d14s2
=> A có số hiệu nguyên tử là 21 " A là nguyên tố Scandium (Sc)
4.19
Nguyên tố A có cấu hình electron lớp ngoài cùng là 4s1. Nguyên tố B có phân lớp cuối là 3p5. Viết cấu hình electron đầy đủ của A, B. Xác định tên A, B.
Phương pháp giải:
Dựa vào
- Số phân lớp trong một lớp electron:
+ 4 lớp đầu (1, 2, 3, 4) có số phân lớp trong mỗi lớp bằng số thứ tự của lớp đó
+ 3 lớp sau (5, 6, 7) đều có 4 phân lớp
- Số electron tối đa trong mỗi phân lớp electron:
|
Phân lớp |
s |
p |
d |
f |
|
Số electron tối đa |
2 |
6 |
10 |
14 |
Lời giải chi tiết:
- Xét nguyên tử A có cấu hình electron lớp ngoài cùng là 4s1
=> Nguyên tử A có thể có những trường hợp sau:
+ TH1: Nguyên tử A không có phân lớp 3d
=> Cấu hình electron của nguyên tử A là 1s22s22p63s23p64s1
=> A có số hiệu nguyên tử là 19 -> A là nguyên tố Potassium (K)
+ TH2: Nguyên tử A có phân lớp 3d
· TH2.1: Phân lớp 3d bán bão hòa: 3d5
=> Cấu hình electron của nguyên tử A là 1s22s22p63s23p63d54s1
=> A có số hiệu nguyên tử là 24 -> A là nguyên tố Chromium (Cr)
· TH2.2: Phân lớp 3d bão hòa: 3d10
=> Cấu hình electron của nguyên tử A là 1s22s22p63s23p63d104s1
=> A có số hiệu nguyên tử là 29 -> A là nguyên tố Copper (Cu)
- Xét nguyên tử B có phân lớp cuối là 3p5
=> Cấu hình electron của nguyên tử B là 1s22s22p63s23p5
=> B có số hiệu nguyên tử là 17 -> B là nguyên tố Chlorine (Cl)
