Đề bài
I. Trắc nghiệm
Câu 1: Nhận định nào sau đây đúng khi nói về 3 nguyên tử \({}_{13}^{26}X,{}_{26}^{55}Y,{}_{12}^{26}Z\)?
- X, Y thuộc cùng một nguyên tố hóa học
- Bán kính nguyên tử X lớn hơn nguyên tử Z
- X và Z là đồng vị của nhau
- Z hơn X 1 neutron
Câu 2: Nguyên tử của nguyên tố M có cấu hình electron là 1s22s22p4. Số elctron độc thân của M là:
- 3 B. 2 C. 1 D.0
Câu 3: Cho một số nguyên tố sau: 10Ne, 11Na, 8O, 16S. Cấu hình electron sau: 1s22s22p6 không phải là của hạt nào trong số các hạt dưới đây
- Nguyên tử Ne B. Ion Na+ C. Ion O2- D. Ion S2-
Câu 4: Chọn câu phát biểu sai?
- Trong nguyên tử luôn có số proton bằng số elctron bằng điện tích hạt nhân
- Tổng số proton và số electron trong một hạt nhân gọi là số khối
- Số khối A là khối lượng tuyệt đối của nguyên tử
- Đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số hạt proton nhưng khác nhau số hạt neutron.
- 1, 3 B. 2, 3, 4 C. 1, 2,3 D. 1, 2
Câu 5: Một nguyên tử X có tổng số electron ở các phân lớp s là 6 và tổng số electron lớp ngoài cùng là 6. Cho biết X thuộc về nguyên tố hóa học nào sau đây
- 8O B. 9F C. 17Cl D. 16S
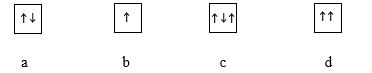
Câu 6: Hình vẽ nào sau đây vi phạm nguyên lý Pauli khi điền electron vào orbital (AO)?
A. a và b B. a C. b D. c và d
Câu 7: Kết luận nào sau đây luôn luôn đúng?
- Các nguyên tố phi kim đều có electron cuối cùng điền vào phân lớp p
- Các nguyên tố nhóm B đều là kim loại
- Các khí hiếm đều có cấu hình electron lớp ngoài cùng ns2np6
- Các nguyên tố nhóm A (phân nhớm chính) đều là kim loại hoặc phi kim
Câu 8: Cho các nguyên tố: K (Z=19), O (Z=8), Al (Z=13), P (Z=15). Dãy gồm các nguyên tố được sắp xếp theo chiều giảm dần bán kính nguyên tử từ trái sang phải:
- K, Al, P, O B. K, Al, O, P
C. O, P, Al, K D. Al, K, O, P
Câu 9: Neon (Z=10) tách ta từ không khí là hỗn hợp của hai đồng vị với % về số nguyên tử tường ứng là 20Ne (91%) và 22Ne (9%). Nguyên tử khối trung bình của Ne là:
- 20,18 B. 21 C. 21,20 D. 21,82
Câu 10: Cấu hình electron nào sau đây là của nguyên tố kim loại
A. 1s22s22p63s2. B. 1s22s22p4.
C. 1s2. D. 1s22s22p6 .
Câu 11: Nhận định nào đúng?
A. Tất cả các nguyên tố mà nguyên tử có 4 electron ở lớp ngoài cùng đều là kim loại.
B. Tất cả các nguyên tố mà nguyên tử có 4 electron ở lớp ngoài cùng đều là phi kim.
C. Nguyên tử có1, 2, 3 electron ở lớp ngoài cùng thường là nguyên tử của nguyên tố kim loại.
D. Tất cả các nguyên tố mà nguyên tử có 7 electron ở lớp ngoài cùng đều là kim loại.
Câu 12: Nguyên tử X có 3 lớp electron, trong đó lớp ngoài cùng có chứa 5 electron. X có điện tích hạt nhân là
A. 14+. B. 15+. C. 15. D. 18.
Câu 13: Dãy nào dưới đây gồm các đồng vị của cùng một nguyên tố hóa học?
- \({}_6^{14}X,{}_7^{14}Y\) B. \({}_9^{19}X,{}_{10}^{20}Y\) C. \({}_{14}^{40}X,{}_{19}^{40}Y\) D. \({}_{18}^{40}X,{}_{18}^{41}Y\)
Câu 14: Nguyên tử X có tổng số hạt proton, nơtron, electron là 34. Biết số nơtron nhiều hơn số proton là 1. Số khối của nguyên tử X là
A. 11. B. 23. C. 35. D. 46.
Câu 15: Cấu hình electron nào sau đây viết không đúng?
A. 1s22s2. B. 1s22s22p5.
C. 1s22s22p6. D. 1s22s22p7.
II. Tự luận
Câu 1: Viết cấu hình electron nguyên tử của các nguyên tố sau, từ đó xác định nguyên tố nào là kim loại, phi kim, khí hiếm? Vì sao?
a) Nguyên tử của nguyên tố X có điện tích hạt nhân là 9+
b) Nguyên tố Y chu kì 3 nhóm IIA
Câu 2: Khí Hydrogen điều chế từ một loại nước chỉ chứa 2 loại đồng vị \({}_1^1H\)(Protium) và \({}_1^2H\)(Deuterium) có nguyên tử khối trung bình bằng 1,008.
a) Trong khí đó có thể có các loại phân tử nào, viết công thức phân tử và tính khối lượng phân tử của mỗi loại.
b) Trong 100 gam nước cho trên có bao nhiêu nguyên tử đồng vị deuterium? (biết nguyên tử khối trung bình của O = 16)
Câu 3: Cho 0,85 gam hỗn hợp hai kim loại (X) thuộc 2 chu kì kế tiếp trong nhóm IA vào cốc chứa 49,18 gam nước thu được dung dịch A và khí B. Để trung hòa dung dịch A cần 30 ml dung dịch HCl 1M.
a) Viết các phương trình xảy ra và xác định hai kim loại
b) Tính nồng độ % của các chất trong dung dịch A.
-------- Hết --------
Đáp án
I. Trắc nghiệm:
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
D |
B |
D |
C |
D |
D |
B |
A |
A |
A |
C |
C |
D |
B |
D |
Giải chi tiết:
Câu 1:
Đáp án D
Giải thích:
A sai vì:
X (Z =13) và Y (Z=26) khác nhau về điện tích hạt nhân -> không thuộc cùng một nguyên tố hóa học
B sai vì: X và Z thuộc cùng một chu kì -> bán kính nguyên tử giảm dần theo chiều tăng của điện tích hạt nhân
-> Bán kính của X nhỏ hơn Z
C sai vì:
X và Z khác nhau về số điện tích hạt nhân
D đúng vì: N = A – Z
\({}_{13}^{26}X\): có N = 26 – 13 = 13
\({}_{12}^{26}Z\): có N = 26 – 12 = 14
Câu 2:
M có cấu hình electron là 1s22s22p4
Biểu diễn electron vào orbital phân lớp chưa bão hòa 2p
-> M có 2 electron độc thân
-> Đáp án B
Câu 3:
Cấu hình electron:
Ne: 1s22s22p6
Na+: 1s22s22p6
O2-: 1s22s22p6
S2-: 1s22s22p63s23p6
-> Đáp án D
Câu 4:
1. sai vì số proton bằng số electron bằng số đơn vị điện tích hạt nhân
2 sai vì số khối bằng tổng số proton và số neutron
3 sai vì số khối A là khối lượng tương đối
4 đúng
-> Đáp án C
Câu 5:
X có tổng số electron ở các phân lớp s là 6
-> Cấu hình e của X gồm có các phân lớp s: 1s, 2s và 3s
X có tổng số electron lớp ngoài cùng là 6
-> Cấu hình electron: 1s22s22p63s23p4
-> Đáp án D
Câu 6:
Nguyên lí Pauli: Mỗi orbital chỉ chứa tối đa 2 electron và có chiều tự quay ngược nhau
-> c và d sai
-> Đáp án D
Câu 7:
A sai vì trường hợp Hydrogen có 1 electron điền vào phân lớp s
C sai vì trường hợp của He là khí hiếm có cấu hình là 1s2
D sai vì có cả khí hiếm
-> Đáp án B
Câu 8:
- Xét Al (Z=13), P (Z=15) thuộc cùng một chu kì
-> Bán kính nguyên tử giảm dần theo chiều tăng của điện tích hạt nhân
-> rAl > rP (1)
- Xét O (Z=8), S(Z=16) ở thuộc cùng một nhóm kế tiếp nhau
Nguyên tử có số lớp e nhiều nhơn thì nguyên tử có bán kính lớn hơn
-> rO < rS (2)
- Xét S(Z=16) và P(Z = 15) thuộc cùng một chu kì
-> Bán kính nguyên tử giảm dần theo chiều tăng của điện tích hạt nhân
-> rP > rS` (3)
Từ (2) và (3) => rP > rO (4)
- Xét K (Z = 19) và Al (Z =13) thuộc 2 chu kì khác nhau và K là nguyên tố ở đầu chu kì 4
=> rK > rAl` (5)
Từ (1), (4), (5) => sắp xếp theo chiều giảm dần bán kính nguyên tử: K, Al, P, O
-> Đáp án A
Câu 9:
Áp dụng CT tính nguyên tử khối trung bình
\(\overline A = \frac{{20.91 + 22.9}}{{100}} = 20,18\)
-> Đáp án A
Câu 10:
Nguyên tố kim loại có 1, 2, 3 elecron ngoài cùng (trừ H, He)
→ Đáp án A
Câu 11:
Đáp án C
Câu 12:
X có 3 lớp e và số e ngoài cùng bằng 5
-> Cấu hình: 1s22s22p6323p3
-> X có 15 electron
-> Điện tích hạt nhân bằng +15
-> Đáp án C
Câu 13:
Đồng vị là các nguyên tố có cùng số proton
-> Đáp án D
Câu 14:
Gọi P, N, E lần lượt là số proton, neutron và electron của X
Tổng số hạt trong nguyên tử nguyên tố X là 34
→ P + N + E =34 (1)
số nơtron nhiều hơn số proton là 1
→ N – P = 1 (2)
Mà P = E (3)
Từ (1), (2) và (3), giải hệ phương trình => P = E = 11 và N = 12
→ A = P + N = 11 + 12 = 23
-> Đáp án B
Câu 15 :
Đáp án D
Sai vì phân lớp p chứa tối đa 6 electron
II. Tự luận
Câu 1 :
a) X có Z = 9
-> Cấu hình : 1s22s22p5
X có 7 electron lớp ngoài cùng
-> X là phi kim
b) Y ở chu kì 3 nhóm IIA
-> Y có cấu hình e: 1s22s22p63s2
-> Y có 2 electron lớp ngoài cùng -> Y là kim loại
Câu 2 :
Gọi kí hiệu đồng vị Proti là H, đồng vị Deuteri là D
a) Các loại phân tử có thể được tạo ra là :
H – H (M=2), H – D (M=3) ; D – D (M=4)
b) Gọi x là tỉ lệ % số nguyên tử của D
→ \(\frac{{100 - x + 2x}}{{100}} = 1,008\)
→ x = 0,8%
Trong 100g nước có : \({n_{{H_2}O}} = \frac{{100}}{{18,016}}\)
→ Số nguyên tử H : \(\frac{{100.2}}{{18,016}}.6,{02.10^{23}}.92\% = 6,{148.10^{24}}\)
→ Số nguyên tử D : \(\frac{{100.2}}{{18,016}}.6,{02.10^{23}}.0,8\% = 5,{346.10^{22}}\)
Câu 3:
Gọi A là kí hiệu chung cho cả 2 nguyên tố kim loại nhóm IA
2A + 2H2O → 2AOH + H2 (1)
AOH + HCl → ACl + H2O (2)
Từ (1) và (2) => nHCl = nAOH = nA = 0,03 mol
-> \({M_A} = \frac{{0,85}}{{0,03}} = \frac{{85}}{3}\)
Vì 2 kim loại kiềm thuộc 2 chu kì kế tiếp
-> 2 kim loại là Na, K
PTHH: 2Na + 2H2O → 2NaOH + H2
a a
2K + 2H2O → 2KOH + H2
b b
b) Gọi a, b lần lượt là số mol của Na, K
Ta có hệ phương trình
\(\)a + b = 0,03
23a + 39b = 0,85
=> a = 0,02 mol, b = 0,01 mol
=> mdd = 49, 18 + 0,85 – 0,015.2 = 50 gam
\(\begin{array}{l}\% {m_{NaOH}} = \frac{{0,02.40.100\% }}{{50}} = 1,6\% \\\% {m_{KOH}} = \frac{{0,01.56.100\% }}{{50}} = 1,12\% \end{array}\)