Đề bài
Câu 1: Điện phân dung dịch hỗn hợp chứa 0,04 mol AgNO3 và 0,05 mol Cu(NO3)2, điện cực trơ, dòng điện 5A, trong 32 phút 10 giây. Khối lượng kim loại bám vào catot là:
A. 6,24 gam.
B. 3,12 gam.
C. 6,5 gam.
D. 7,24 gam.
Câu 2: Cho khí CO dư đi qua hỗn hợp gồm CuO, Al2O3, MgO (nung nóng). Khi phản ứng xảy ra hoàn toàn thu được chất rắn gồm:
A. Cu, Al, Mg.
B. Cu, Al, MgO.
C. Cu, Al2O3, MgO.
D. Cu, Al2O3, Mg.
Câu 3: Dẫn V lít (đktc) khí CO2 qua 100ml dung dịch Ca(OH)2 1M thu được 6 gam kết tủa. Lọc bỏ kết tủa, lấy dung dịch nước lọc đun nóng lại thu được kết tủa nữa. Giá trị của V là:
A. 1,344 lít.
B. 2,24 lít.
C. 3,136 lít.
D. 3,136 lít hoặc 1,344 lít.
Câu 4: Để khử hoàn toàn 30 gam hỗn hợp CuO, FeO, Fe2O3, Fe3O4, MgO cần dùng 5,6 lít khí CO (ở đktc). Khối lượng chất rắn sau phản ứng là:
A. 28 gam.
B. 26 gam.
C. 22 gam.
D. 24 gam.
Câu 5: Để làm sạch loại thủy ngân có lẫn tạp chất là Zn,Sn,Pb cần khuấy loại thủy ngân này trong:
A. Dung dịch Sn(NO3)2.
B. Dung dịch Hg(NO3)2.
C. Dung dịch Zn(NO3)2.
D. Dung dịch Pb(NO3)2.
Câu 6: Al2O3, Al(OH)3 bền trong:
A. Dung dịch HCl.
B. Dung dịch Ca(OH)2.
C. H2O.
D. Dung dịch Ba(OH)2.
Câu 7: Chất nào dưới đây góp phần nhiều nhất vào sự hình thành mưa axit ?
A. Ozon.
B. Dẫn xuất flo của hidrocacbon.
C. Cacbon đioxit.
D. Lưu huỳnh đioxit.
Câu 8: Để phân biệt các khí CO, CO2, O2 và SO2 có thể dùng
A. tàn đóm cháy dở và nước brom.
B. dung dịch Na2CO3 và nước brom.
C. tàn đóm, nước vôi trong và dung dịch K2CO3.
D. tàn đóm cháy dở, nước vôi trong và nước brom.
Câu 9: Hòa tan hết 9,6 gam hỗn hợp hai kim loại kiềm thuộc 2 chu kì liên tiếp vào nước được 3,36 lít khí (đktc). Hai kim loại kiềm đó là:
A. K, Rb.
B. Rb, Cs.
C. Li, Na.
D. Na, K.
Câu 10: Cho 50 gam hỗn hợp X gồm bột Fe3O4 vàCu vào dung dịch HCl dư. Kết thúc phản ứng còn lại 20,4 gam chất rắn không tan. Phần trăm về khối lượng của Cu trong hỗn hợp X là:
A. 53,6%.
B. 40,8%.
C. 20,4%.
D. 40,0 %.
Câu 11: Cho bột Al vào dung dịch KOH dư, thấy hiện tượng:
A. Sủi bọt khí, bột Al tan dần đến hết và thu được dung dịch màu xanh lam.
B. Sủi bọt khí, bột Al không tan hết và thu được dung dịch màu xanh lam.
C. Sủi bọt khí, bột Al tan dần đến hết và thu được dung dịch không màu.
D. Sủi bọt khí, bột Al không tan hết và thu được dung dịch không màu.
Câu 12: Hòa tan hết 0,56 gam Fe trong lượng dư H2SO4 đặc nóng thu được sản phẩm khử duy nhất là bao nhiêu lít SO2 (đktc) ?
A. 0,56 lít.
B. 0,336 lít.
C. 0,448 lít.
D. 0,224 lít.
Câu 13: Trong quá trình sản xuất gang, xỉ lò là chất:
A. SiO2 và C.
B. MnO2 và CaO.
C. MnSiO3.
D. CaSiO3.
Câu 14: Lớp ozon ở tầng bình lưu của khí quyển là tấm lá chắn tia tử ngoại của Mặt trời, bảo vệ sự sống trên Trái đất. Hiện tượng suy giảm tầng ozon đang là một vấn đề môi trường toàn cầu. Nguyên nhân của hiện tượng này là do:
A. Chất thải CFC do con người gây ra.
B. Các hợp chất hữu cơ.
C. Sự thay đổi của khí hậu.
D. Chất thải CO2 .
Câu 15: Sục CO2 vào dung dịch Ba(OH)2 ta có kết quả theo đồ thị như hình bên. Giá trị của x là:
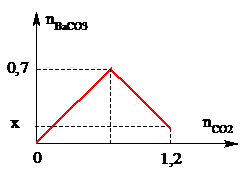
A. 0,20 mol.
B. 0,10 mol.
C. 0,15 mol.
D. 0,18 mol.
Câu 16: Phản ứng nào sau đây không đúng?
A. 2Cr3+ + Zn → 2Cr2+ + Zn2+
B. 2CrO2- + 3Br2 + 8OH- → 2CrO42- + 6Br- + 4H2O
C. 2Cr3+ + 3Br2 + 16OH- → 2CrO42- + 6Br- + 8H2O
D. 2Cr3+ + 3Fe → 2Cr+ 3Fe2+
Câu 17: Al có thể tan được trong nhóm các dung dịch nào sau:
A. CuSO4, MgCl2.
B. HCl, H2SO4 loãng.
C. FeCl2, KCl.
D. (HNO3, H2SO4) đặc nguội.
Câu 18: Người Mông Cổ rất thích dùng bình bằng Ag để đựng sữa ngựa. Bình bằng Ag bảo quản được sữa ngựa lâu không bị hỏng là do:
A. Bình bằng Ag bền trong không khí.
B. Ag là kim loại có tính khử rất yếu.
C. Bình làm bằng Ag, chứa các ion Ag+ có tính oxi hóa mạnh.
D. Ion Ag+ có khả năng diệt trùng, diệt khuẩn (dù nồng độ rất nhỏ).
Câu 19: Hai kim loại đều thuộc nhóm IIA trong bảng tuần hoàn là:
A. Sr, K.
B. Ca, Ba.
C. Na, Ba.
D. Be, Al.
Câu 20: Fe có thể tan trong dung dịch chất nào sau đây?
A. FeCl3.
B. AlCl3.
C. FeCl2.
D. MgCl2.
Câu 21: Cho 4,08 gam Mg tác dụng với dung dịch hỗn hợp Cu(NO3)2 và H2SO4 đun nóng, khuấy đều đến khi phản ứng xảy ra hoàn toàn được dung dịch X và 0,896 lít hỗn hợp khí Y (đktc) gồm hai khí không màu, trong đó có một khí hóa nâu ngoài không khí và 1,76 gam hỗn hợp hai kim loại có cùng số mol. Biết tỉ khối của Y đối với H2 là 8. Khối lượng muối tạo thành trong dung dịch X gần nhất với giá trị nào sau đây?
A. 19,5 gam.
B. 24,0 gam.
C. 39,0 gam.
D. 21,5 gam.
Câu 22: Để nhận biết ion Ba2+ không dùng ion:
A. SO42-.
B. CrO42-.
C. Cr2O72-.
D. S2-.
Câu 23: Cho x mol Fe tác dụng với y mol AgNO3 đến phản ứng hoàn toàn thu được dung dịch chứa hai muối của cùng một kim loại. Số mol hai muối lần lượt là:
A. (y - 3x) và (4x - y).
B. x và (y - x).
C. (3x - y) và (y - 2x).
D. (y - x) và (2x - y).
Câu 24: Cho hỗn hợp X gồm 5,60 gam Fe và 4,00 gam Cu vào dung dịch HNO3. Phản ứng xong,có khí NO thoát ra (sản phẩm khử duy nhất) và còn 0,80 gam một kim loại. Tổng số gam muối khan thu được là:
A. 27,18.
B. 33,60.
C. 27,40.
D. 32,45.
Câu 25: Đem hỗn hợp Al và Al(OH)3 tan hết trong dung dịch NaOH được 3,36 lít H2 (đktc). Nếu đem hỗn hợp trên nung trong không khí đến khối lượng không đổi thu được duy nhất 10,2 gam một chất rắn. Số mol Al và Al(OH)3 lần lượt là:
A. 0,15 và 0,05.
B. 0,1 và 0,05.
C. 0,1 và 0,1
D. 0,15 và 0,1.
Câu 26: Hòa tan hết 1,08 gam hỗn hợp Cr và Fe trong dung dịch HCl loãng, nóng thu được 448 ml khí (đktc). Khối lượng crom có trong hỗn hợp là:
A. 1,015 gam.
B. 0,520 gam.
C. 0,065 gam.
D. 0,560 gam.
Câu 27: Cho 200ml dung dịch AlCl3 1,5M vào V lít dung dịch NaOH 0,5M thu được 15,6 gam kết tủa . Giá trị lớn nhất của V là:
A. 1,2 lít.
B. 1,8 lít.
C. 2,4 lít.
D. 2 lít.
Câu 28: Khi điều chế kim loại, các ion kim loại đóng vai trò là chất
A. nhận proton.
B. bị oxi hoá.
C. bị khử.
D. cho proton.
Câu 29: Cho các cặp chất sau: FeCl2 và H2S; CuS và HCl; Fe2(SO4)3 và H2S; NaOH đặc và SiO2; Na2ZnO2 và HCl. Số cặp chất xảy ra phản ứng là:
A. 5.
B. 3.
C. 4.
D. 2.
Câu 30: Cấu hình electron nào sau đây là của Fe?
A. [Ar]4s23d6.
B. [Ar]3d8.
C. [Ar]3d64s2.
D. [Ar]3d74s1.
Câu 31: Cho từ từ dung dịch NH3 đến dư vào dung dịch AlCl3. Hiện tượng quan sát được:
A. có kết tủa keo trắng tan dần đến hết.
B. có kết tủa keo trắng rồi tan, sau đó lại có kết tủa.
C. có kết tủa keo trắng, không thấy kết tủa tan.
D. dung dịch trong suốt.
Câu 32: Anion gốc axit nào sau đây có thể làm mềm nước cứng?
A. SO42-.
B. PO43-.
C. NO3-.
D. ClO4-.
Câu 33: Cho 1 mẩu Na vào dung dịch CuSO4, hiện tượng quan sát được là:
A. có khí thoát ra và có kết tủa xanh lam.
B. chỉ có kết tủa màu đỏ.
C. Có khí thoát ra và có kết tủa màu đỏ.
D. chỉ có khí thoát ra.
Câu 34: Cho một lượng bột Al vào dung dịch CuSO4 dư, lấy rắn thu được cho tác dụng dung dịch HNO3 dư thấy sinh ra 2,24 lít NO (đktc). Nếu đem lượng Al trên tác dụng hết với dung dịch HNO3 sẽ thu được thể tích N2 đktc là:
A. 0,896 lít.
B. 0,448 lít.
C. 0,336 lít.
D. 0,672 lít.
Câu 35: Hỗn hợp X gồm Fe, FeO, Fe3O4 và Fe2O3. Đem hòa tan 14,4 gam hỗn hợp X trong lượng dư dung dịch H2SO4 đậm đặc, nóng, có 6,72 lít khí SO2 duy nhất thoát ra (đktc). Sau khi kết thúc phản ứng, đem cô cạn dung dịch, thu được m gam muối khan. Trị số của m là:
A. 48.
B. 44.
C. 40.
D. 52 .
Câu 36: Tại những bãi đào vàng, nước sông đã nhiễm một loại hóa chất cực độc do thợ vàng sử dùng để tách vàng khỏi cát và tạp chất. Đất ở ven sông cũng bị nhiễm chất độc này. Chất độc này cũng có nhiều trong vỏ sắn. Chất độc đó là:
A. Xianua.
B. Nicôtin.
C. Thủy ngân.
D. Đioxin
Câu 37: Nhiệt phân hoàn toàn 81 gam Ca(HCO3)2 thu được V lít khí CO2 (đktc). Giá trị của V là:
A. 5,6.
B. 33,6.
C. 11,2.
D. 22,4.
Câu 38: Ion kim loại nào sau đây làm ngọn lửa đèn khí nhuốm màu vàng tươi ?
A. Ca2+.
B. Na+.
C. K+.
D. Ba2+.
Câu 39: Chỉ dùng thêm chất nào sau đây có thể phân biệt được các oxit: Na2O, ZnO, CaO, MgO?
A. C2H5OH.
B. H2O.
C. dung dịch HCl.
D. dung dịch CH3COOH.
Câu 40: Dung dịch HCl, H2SO4 loãng sẽ oxi hóa crom đến mức oxi hóa:
A. +2.
B. +3.
C. +4.
D. +6.
----- HẾT -----
Lời giải chi tiết
Câu 1:
Phương pháp:
Bài toán điện phân: ne = I.t/F
Hướng dẫn giải:
- Có: ne = It/F = 5.(32.60 + 10): 96500 = 0,1 mol
- Thứ tự điện phân:
Ag+ + 1e → Ag
Mol 0,04 → 0,04 → 0,04
(ne còn = 0,1 – 0,04 = 0,06 mol)
Cu2+ + 2e → Cu
Mol 0,03 ¬ 0,06 → 0,03
=> Kim loại bám ở catot gồm: 0,04 mol Ag và 0,03 mol Cu
=> mKL = 0,04.108 + 0,03.64 = 6,24g
Đáp án A
Câu 2:
Phương pháp:
Chất khử trung bình (C, CO, H2) chỉ khử được những oxit của KL đứng sau Al trong dãy điện hóa.
Hướng dẫn giải:
CO không khử được Al2O3 và MgO => Chất rắn sau phản ứng gồm: Cu, Al2O3, MgO.
Đáp án C
Câu 3:
Phương pháp:
Bài toán CO2 + OH-
- Biện luận sản phẩm của phản ứng là 1 muối hay 2 muối
Hướng dẫn giải:
Dung dịch sau phản ứng khi đun nóng có tạo thêm kết tủa => có tạo ra HCO3-
nCa(OH)2 = 0,1 mol ; nCaCO3 = 6: 100 = 0,06 mol
Bảo toàn Ca: nCa(OH)2 = nCaCO3 + nCa(HCO3)2 => nCa(HCO3)2 = 0,1 – 0,06 = 0,04 mol
=> Bảo toàn C: nCO2 = nCaCO3 + 2nCa(HCO3)2 = 0,06 + 0,04.2 = 0,14 mol
=> VCO2 = 3,136 lít
Đáp án C
Câu 4:
Phương pháp:
Bảo toàn nguyên tố.
Hướng dẫn giải:
Quy phản ứng về dạng: [O]Oxit + CO → CO2
=> nCO = nO = 5,6 : 22,4 = 0,25 mol
=> mKL = mOxit – mO = 30 – 0,25.16 = 26g
Đáp án B
Câu 5:
Phương pháp:
Dựa vào dãy hoạt động hóa học kim loại
Hướng dẫn giải:
Các kim loại đều có thể phản ứng được với Hg2+ (Hg có tính khử yéu hơn) => tạo sản phẩm là Hg => Không bị lẫn kim loại khác
Đáp án B
Câu 6:
Hướng dẫn giải:
Al2O3 và Al(OH)3 đều không phản ứng được với H2O
Đáp án C
Câu 7:
Phương pháp:
Hóa học và vấn đề xã hội – môi trường
Hướng dẫn giải:
SO2 góp phần nhiều nhất vào sự hình thành mưa axit
Đáp án D
Câu 8:
Phương pháp: Nhận biết các chất vô cơ
Hướng dẫn giải:
Để nhận biết các khí trên ta dùng: tàn đóm cháy dở, nước vôi trong và nước brom.
- Tàn đóm cháy dở (bùng cháy to hơn): O2
- Nước vôi trong (tạo kết tủa trắng): SO2, CO2
SO2 + Ca(OH)2 → CaSO3 + H2O
CO2 + Ca(OH)2 → CaCO3 + H2O
- Nước Brom (mất màu): SO2
SO2 + Br2 + 2H2O → 2HBr + H2SO4
- Không có hiện tượng nào: CO
Đáp án D
Câu 9:
Phương pháp: Quy 2 kim loại về thành 1 kim loại kiềm M
=> Tính toán theo 1 phương trình phản ứng
=> Tính được M trung bình => Tìm được tên 2 kim loại
Hướng dẫn giải:
Quy 2 kim loại về thành 1 kim loại kiềm M
M + H2O → MOH + 0,5H2 (nH2 = 3,36 : 22,4 = 0,15 mol)
Mol 0,3 ¬ 0,15
=> Mtb = 9,6 : 0,3 = 32 g/mol
=> 2 kim loại là Na(23) và K(39)
Đáp án D
Câu 10:
Phương pháp: Chất rắn không tan là Cu dư.
PTHH:
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
Cu + 2FeCl3 → CuCl2 + 2FeCl2
Tính toán theo PTHH suy ra số mol Fe3O4.
Hướng dẫn giải:
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
Mol x → 2x
Cu + 2FeCl3 → CuCl2 + 2FeCl2
Mol x ¬ 2x
Sau phản ứng còn chất rắn => chính là Cu dư
=> khối lượng kim loại phản ứng là: 50 – 20,4 = 29,6g = 232x + 64x
=> x = 0,1 mol
=> %mFe3O4 = 0,1.232 : 50 = 46,4 %
=> %mCu = 100% - %mFe3O4 = 53,6 %
Đáp án A
Câu 11:
Phương pháp: Tính chất hóa học của Al
Hướng dẫn giải:
Al tan trong dung dịch KOH theo PTHH: Al + KOH + H2O → KAlO2 + 1,5H2↑
Do KOH dư nên Al tan dần đến hết và thu được dung dịch không màu.
Đáp án C
Câu 12:
Phương pháp: Bảo toàn electron
Hướng dẫn giải:
nFe = 0,56 : 56 = 0,01 mol
Bảo toàn electron: 3nFe = 2nSO2
=> nSO2 = 1,5nFe = 1,5.0,01 = 0,015 mol
=> VSO2 = 0,015. 22,4 = 0,336 lít
Đáp án B
Câu 13:
Phương pháp: Phương pháp điều chế hợp kim của sắt
Hướng dẫn giải:
Trong quá trình sản xuất gang, xỉ lò là CaSiO3
Đáp án D
Câu 14:
Phương pháp: Hóa học và vấn đề môi trường – xã hội
Hướng dẫn giải:
CFC do con người gây ra có thể làm thủng tầng ozon nên gây nên hiện tượng suy giảm tầng ozon.
Đáp án A
Câu 15:
Phương pháp: CO2 + Dung dịch Kiềm
- TH1: CO2 dư (nCO2 > nOH)
=> Chỉ có phản ứng: CO2 + OH- → HCO3-
- TH2: OH- dư (nOH > 2nCO2)
=> Chỉ có phản ứng: CO2 + 2OH- → CO32- + H2O
- TH3: Có 2 phản ứng (nCO2 < nOH < 2nCO2)
CO2 + OH- → HCO3-
CO2 + 2OH- → CO32- + H2O
=> nCO3 = nOH – nCO2
Và nHCO3 = nCO2 – nCO3
Hướng dẫn giải:
- Tại nBaCO3 = 0,7 mol (kết tủa đạt max)
=> nBaCO3 = nBa(OH)2 = 0,7 mol
=> nOH = 2.0,7 = 1,4 mol
- Tại nCO2 = 1,2 mol thì kết tủa bị hòa tan 1 phần
=> nBaCO3 = nOH – nCO2
=> nBaCO3 = 0,7.2 – 1,2 = 0,2 mol = x
Đáp án A
Câu 16:
Phương pháp: Tính chất hóa học hợp chất của Crom
Hướng dẫn giải:
D sai vì 2Cr3+ + Fe → 2Cr2+ + Fe2+
Đáp án D
Câu 17:
Phương pháp: Tính chất hóa học của Al
Hướng dẫn giải:
A loại vì Al không phản ứng được với MgCl2
B đúng
C loại vì Al không phản ứng được với KCl
D loại vì Al bị thụ động trong axit HNO3 đặc nguội và H2SO4 đặc nguội
Đáp án B
Câu 18:
Phương pháp:
Tính chất của Ag
Hướng dẫn giải:
Bình bằng Ag bảo quản được sữa ngựa lâu không bị hỏng là do Ion Ag+ có k/năng diệt trùng,diệt khuẩn (dù nồng độ rất nhỏ).
Đáp án D
Câu 19:
Hướng dẫn giải:
Hai kim loại đều thuộc nhóm IIA trong bảng tuần hoàn là Ca, Ba.
Đáp án B
Câu 20:
Phương pháp: Lý thuyết về dãy hoạt động hóa học của kim loại
Hướng dẫn giải:
Fe có thể phản ứng được với các kim loại/ion đứng sau trongdãy hoạt động hóa học kim loại.
Fe + 2Fe3+ → 3Fe2+
Đáp án A
Câu 21:
Phương pháp:
- Biện luận các chất trong hỗn hợp khí và hỗn hợp kim loại
=> Chất nào dư, chất nào hết sau phản ứng
=> Số mol các chất trong các hỗn hợp
=> Số mol các chất phản ứng ban đầu
=> Tìm được các muối trong dung dịch X
(Chú ý: kiểm tra xem trong X có muối NH4+ hay không )
Hướng dẫn giải:
Mg + (Cu(NO3)2, H2SO4) . Ta thấy:
+) Tạo hỗn hợp 2 kim loại => Cu, Mg dư
+) Tạo hỗn hợp 2 khí có M = 8.2 = 16 g/mol.
1 khí hóa nâu ngoài không khí => NO (M = 30)
=> Khí còn lại phải có M < 16 => H2 => H+ dư hơn so với NO3-.
- nY = 0,896: 22,4 = 0,04 mol = nNO + nH2
Và: mY = mNO + mH2 = 30nNO + 2nH2 = 16.0,04 = 0,64
=> nNO = nH2 = 0,02 mol
- Thứ tự phản ứng sẽ là:
Mg + H+ + NO3-
Mg + Cu2+
Mg + H+
- Gọi số mol Cu2+ phản ứng là x => nCu = x = nMg dư
=> mCu + mMg dư = 1,76g = 64x + 24x => x = 0,02 mol
nMg bđ = 4,08: 24 = 0,17 mol
=> nMg pứ = 0,17 – 0,02 = 0,15 mol
Giả sử có NH4+ trong dung dịch X
=> Bảo toàn Nito: 2nCu(NO3)2 = nNO + nNH4
=> nNH4 = 2.0,02 – 0,02 = 0,02 mol
=> Trong dung dịch X có 0,15 mol MgSO4 và 0,01 mol (NH4)2SO4
=> mmuối = 0,15.120 + 0,01.132 = 19,32g (Gần nhất với giá trị 19,5g)
Đáp án A
Câu 22:
Phương pháp: Tính chất hóa học của Bari
Hướng dẫn giải:
Vì BaS tan trong nước nên không dùng để nhận biết ion Ba2+
Đáp án D
Câu 23:
Phương pháp: Dung dịch sau phản ứng chứa hai muối của cùng một kim loại => Fe3+ và Fe2+
=> AgNO3 sẽ bị phản ứng hết.
Tính toán theo PTHH:
Fe + 2Ag+ → Fe2+ + 2Ag
Fe2+ + Ag+ → Fe3+ + Ag
Hướng dẫn giải:
Dung dịch sau phản ứng chứa hai muối của cùng một kim loại => Fe3+ và Fe2+
=> AgNO3 sẽ bị phản ứng hết.
- Vậy các phản ứng xảy ra là:
Fe + 2Ag+ → Fe2+ + 2Ag
mol x → 2x → x [nAg+ dư = (y – 2x) ]
Fe2+ + Ag+ → Fe3+ + Ag
mol (y – 2x)
=> nFe2+ = x – (y – 2x) = 3x - y
nFe3+ = y – 2x
Đáp án C
Câu 24:
Phương pháp:
Biện luận chất rắn sau phản ứng là kim loại gì
=> Thành phần các chất trong dung dịch
=> Số mol các muối trong dung dịch
Hướng dẫn giải:
Thứ tự phản ứng:
Fe + H+ + NO3-
Fe3+ + Cu
=> Chất rắn còn lại chính là Cu dư và dung dịch có Fe2+, không có Fe3+
=> mCu pứ = 4 – 0,8 = 3,2g => nCu pứ = 3,2: 64 = 0,05 mol
Sản phẩm khử duy nhất là NO nên sản phẩm khử không có NH4NO3
Vậy thành phần của muối là: 0,1 mol Fe(NO3)2 ; 0,05 mol Cu(NO3)2
=> mmuối = 0,1.180 + 0,05.188 = 27,4g
Đáp án C
Câu 25:
Phương pháp:
Từ số mol H2 tính được số mol Al trong hỗn hợp ban đầu.
Chất rắn sau nung là Al2O3. Bảo toàn nguyên tố Al ta có: nAl + nAl(OH)3 = 2nAl2O3
=> nAl(OH)3
Hướng dẫn giải:
- Al và Al(OH)3 + NaOH thì chỉ Al phản ứng tạo khí H2
nH2 = 3,36: 22,4 = 0,15 mol
Al + NaOH + H2O → NaAlO2 + 1,5H2
Mol 0,1 ¬ 0,15
- Khi Al và Al(OH)3 nung trong không khí (có Oxi) thì đều tạo ra sản phẩm là Al2O3
=> Bảo toàn Al: nAl + nAl(OH)3 = 2nAl2O3 = 2.10,2 : 102 = 0,2 mol
=> nAl(OH)3 = 0,2 – 0,1 = 0,1 mol
Vậy số mol Al và Al(OH)3 lần lượt là: 0,1 và 0,1 mol
Đáp án C
Câu 26:
Phương pháp:
Bảo toàn electron
Hướng dẫn giải:
nH2 = 0,448: 22,4 = 0,02 mol
Bảo toàn e: 2nCr + 2nFe = 2nH2 = 0,04 mol
Và: mhh = 52nCr + 56nFe = 1,08g
=> nCr = nFe = 0,01 mol
=> mCr = 0,01.52 = 0,52g
Đáp án B
Câu 27:
Phương pháp:
Giá trị lớn nhất của V dd NaOH để thu được một lượng kết tủa Al(OH)3 thì khi có sự hòa tan kết tủa.
Hướng dẫn giải:
nAl3+ = 0,2.1,5 = 0,3 mol
nAl(OH)3 = 15,6 : 78 = 0,2 mol < nAl3+
=> Để thể tích NaOH đạt max thì kết tủa bị hòa tan 1 phần
=> nOH max = 4nAl3+ - nAl(OH)3 = 4.0,3 – 0,2 = 1 mol
=> Vdd NaOH = 1 : 0,5 = 2 lít
Đáp án D
Câu 28:
Phương pháp:
Chất khử (chất bị oxi hóa) là chất nhường e, chất oxi hóa (chất bị khử) là chất nhận e.
Hướng dẫn giải:
Chất khử (chất bị oxi hóa) là chất nhường e, chất oxi hóa (chất bị khử) là chất nhận e.
Khi điều chế kim loại, các ion kim loại nhận e để tạo thành kim loại do đó chúng đóng vai trò là chất bị khử
Đáp án C
Câu 29:
Phương pháp:
Tính chất hóa học các chất vô cơ
Hướng dẫn giải:
FeCl2 và H2S; CuS và HCl không phản ứng
Fe2(SO4)3 + H2S → 2FeSO4 + S + H2SO4
2NaOHđặc + SiO2 → Na2SiO3 + H2O
Na2ZnO2 + 4HCl → 2NaCl + ZnCl2 + 2H2O
=> Vậy có 3 cặp chất có phản ứng
Đáp án B
Câu 30:
Phương pháp: Cách viết cấu hình electron nguyên tử
Hướng dẫn giải:
26Fe: 1s22s22p63s23p63d64s2 hay [Ar]3d64s2.
Đáp án C
Câu 31:
Phương pháp: Tính chất hóa học của Al3+
Hướng dẫn giải:
Dẫn NH3 vào dung dịch AlCl3 có phản ứng hóa học sau:
AlCl3 + 3NH3 + 3H2O → Al(OH)3 + 3NH4Cl
Vì NH3 là bazo yếu nên không thể hòa tan được hidroxit Al(OH)3
=> Hiện tượng: Có kết tủa keo trắng không tan
Đáp án C
Câu 32:
Phương pháp: Phương pháp làm mềm nước cứng:
- Với nước cứng tạm thời:
+ Đun sôi.
+ Thêm Ca(OH)2 vừa đủ.
+ Thêm các dung dịch kiềm khác, dung dịch muối CO32-, dung dịch PO43-.
- Với nước cứng vĩnh cửu:
Thêm các dung dịch muối CO32-, dung dịch PO43-.
Hướng dẫn giải:
PO43- có thể làm mềm nước cứng do có thể loại bỏ các ion Ca2+ và Mg2+ dưới dạng kết tủa Ca3(PO4)2 và Mg3(PO4)2
Đáp án B
Câu 33:
Phương pháp: Tính chất hóa học kim loại kiềm
Hướng dẫn giải:
Na + H2O → NaOH + 0,5H2↑
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
=> Hiện tượng: Có khí thoát ra và có kết tủa xanh lam.
Đáp án A
Câu 34:
Phương pháp: Bảo toàn electron
Hướng dẫn giải:
- Khi Al + CuSO4 dư: ne = 3nAl = 2nCu
- Khi Cu + HNO3 dư: ne = 2nCu = 3nNO
=> nAl = nNO = 2,24 : 22,4 = 0,1 mol
- Khi Al + HNO3: ne = 3nAl = 10nN2
=> nN2 = 3.0,1: 10 = 0,03 mol
=> VN2 = 0,03.22,4 = 0,672 lít
Đáp án D
Câu 35:
Phương pháp:
Quy hỗn hợp X về dạng Fe và O.
Áp dụng định luật bảo toàn e với Fe, O và SO2 => số mol các chất
=> Khối lượng muối khan
Hướng dẫn giải:
Quy hỗn hợp X về dạng Fe và O.
=> mX = 56nFe + 16nO = 14,4g (1)
- Khi X + H2SO4: Bảo toàn e: 3nFe = 2nO + 2nSO2
=> 3nFe – 2nO = 2.6,72 : 22,4 = 0,6 mol (2)
Từ (1,2) => nFe = 0,24; nO = 0,06 mol
Vậy muối trong dung dịch sau phản ứng sẽ là: 0,12 mol Fe2(SO4)3
=> mFe2(SO4)3 = 0,12.400 = 48g
Đáp án A
Câu 36:
Hướng dẫn giải:
Đất ở ven sông cũng bị nhiễm Xianua (CN-). Chất độc này cũng có nhiều trong vỏ sắn.
Hóa chất cực độc này do thợ vàng sử dùng để tách vàng khỏi cát và tạp chất.
Đáp án A
Câu 37:
Phương pháp: Tính toán theo phương trình hóa học:
Ca(HCO3)2 → CaCO3 + CO2 + H2O
Hướng dẫn giải:
Ca(HCO3)2 → CaCO3 + CO2 + H2O (nCa(HCO3)2 = 81: 162 = 0,5 mol)
Mol 0,5 → 0,5 → 0,5
CaCO3 → CaO + CO2
Mol 0,5 → 0,5
=> nCO2 = 0,5 + 0,5 = 1 mol
=> VCO2 = 1.22,4 = 22,4 lít
Đáp án D
Câu 38:
Phương pháp:
Tính chất hóa học các chất vô cơ
Hướng dẫn giải:
Na+ làm ngọn lửa đèn khí nhuốm màu vàng tươi
Đáp án B
Câu 39:
Phương pháp:
Nhận biết các chất vô cơ
Chú ý: Ca(OH)2 tan ít trong nước.
Hướng dẫn giải:
Ta dùng H2O để nhận biết các oxit đề bài cho.
- Khi cho nước dư vào 4 chất:
+) Có kết tủa: CaO (vì tạo Ca(OH)2 ít tan), MgO, ZnO
+) Tan hoàn toàn: Na2O
- Khi cho NaOH (tạo ra từ Na2O + H2O) vào 3 chất rắn trên
+) Còn kết tủa: CaO, MgO
+) Kết tủa tan: ZnO (ZnO + 2NaOH → Na2ZnO2 + H2O)
- Lọc 2 dung dịch khi cho CaO và MgO vào (chỉ còn nước trong), sau đó cho ZnO vào thì:
+) ZnO tan: CaO (Vì phần Ca(OH)2 tan có phản ứng với ZnO)
+) Kết tủa: MgO
Đáp án B
Câu 40:
Phương pháp:
Tính chất hóa học của Crom
Hướng dẫn giải:
Dung dịch HCl, H2SO4 loãng sẽ oxi hóa crom đến mức oxi hóa +2
Đáp án A
soanvan.me
