Câu hỏi 1 :
Nội dung của mô hình hiện đại về sự chuyển động của electron trong nguyên tử là:
- A Trong nguyên tử, các electron chuyển động xung quanh hạt nhân không theo quỹ đạo xác định.
- B Trong nguyên tử, các lectron chuyển động xung quanh hạt nhân theo những quỹ đạo tròn.
- C Trong nguyên tử, các electron chuyển động xung quanh hạt nhân theo những quỹ đạo hình bầu dục.
- D Trong nguyên tử, các electron chuyển động xung quanh hạt nhân theo những quỹ đạo xác định nhưng quỹ đạo có hình dạng bất kì.
Đáp án: A
Lời giải chi tiết:
Trong nguyên tử, các electron chuyển động xung quanh hạt nhân không theo quỹ đạo xác định.
Câu hỏi 2 :
Cho 2 nguyên tố: X (Z = 14), Y (Z =17). Phát biểu nào sau đây đúng?
- A Tính phi kim: X > Y.
- B X, Y thuộc hai chu kì khác nhau trong bảng tuần hoàn.
- C Độ âm điện: X > Y.
- D Bán kính nguyên tử: X > Y.
Đáp án: D
Phương pháp giải:
- Xác định vị trí của X, Y trong BTH
- Dựa vào quy luật biến đổi tuần hoàn các tính chất của các nguyên tử các nguyên tố để chọn ra phát biểu đúng
+ Tính phi kim: Trong cùng một chu kì, khi đi từ trái sang phải thì tính phi kim tăng dần. Trong cùng một nhóm, khi đi từ trên xuống dưới thì tính phi kim giảm dần
+ Độ âm điện biến đổi cùng với tính phi kim
+ Bán kính: Trong cùng một chu kì, khi đi từ trái sang phải thì bán kính giảm dần. Trong cùng một nhóm, khi đi từ trên xuống dưới thì bán kính tăng dần
Lời giải chi tiết:
Cấu hình e của X và Y:
X (Z = 14): 1s22s22p63s23p2
Y (Z =17): 1s22s22p63s23p5

A. Sai vì tính phi kim X < Y
B. Sai vì X và Y thuộc cùng chu kì 3
C. Sai vì độ âm điện X < Y
D. Đúng
Câu hỏi 3 :
Nguyên tử của nguyên tố R có cấu hình electron 1s22s22p3, công thức hợp chất khí với hidro và công thức oxit cao nhất là
- A RH2, RO
- B RH3, R2O5
- C RH5, R2O3
- D RH4, RO2
Đáp án: B
Phương pháp giải:
Tổng hóa trị của một nguyên tố trong oxit cao nhất và trong hợp chất khí với H bằng 8
Lời giải chi tiết:
R có cấu hình electron 1s22s22p3 => R có 5e ở lớp ngoài cùng => R ở nhóm VA
=> Oxit cao nhất: R2O5
=> Hợp chất khí với H: RH3
Câu hỏi 4 :
Cấu hình electron của nguyên tố Na (Z = 11) là:
- A 1s22s22p63s1.
- B 1s22s22p7.
- C 1s22p63s23p1.
- D 1s21p62s22p1.
Đáp án: A
Phương pháp giải:
- Quy ước cách viết cấu hình electron nguyên tử:
+ Số thứ tự lớp electron bằng các chữ số: 1, 2, 3
+ Phân lớp được kí hiệu bằng chữ cái thường: s, p, d, f
+ Số electron trong phân lớp được ghi bằng chỉ số ở phía trên bên phải kí hiệu của phân lớp: s2, p6, d10…
- Cách viết cấu hình electron nguyên tử:
+ Xác định số electron của nguyên tử.
+ Các electron được phân bố theo thứ tự tăng dần các mức năng lượng AO, tuân theo các nguyên lí Pau-li, nguyên lí vững bền và quy tắc Hun.
+ Viết cấu hình electron theo thứ tự các phân lớp trong 1 lớp và theo thứ tự của các lớp electron.
+ Lưu ý: các electron được phân bố vào các AO theo phân mức năng lượng tăng dần và có sự chèn mức năng lượng. Tuy nhiên, khi viết cấu hình electron, các phân mức năng lượng cần được sắp xếp lại theo từng lớp.
Lời giải chi tiết:
Đáp án A
Câu hỏi 5 :
Các nguyên tố xếp chu kỳ 6 có số lớp electron trong nguyên tử là:
- A 3
- B 5
- C 6
- D 7
Đáp án: C
Phương pháp giải:
Số thứ tự chu kì = số lớp electron
Lời giải chi tiết:
Những nguyên tố thuộc chu kì 6 có 6 lớp electron.
Câu hỏi 6 :
Trong bảng hệ thống tuần hoàn, trong 1 phân nhóm chính (nhóm A) theo chiều tăng dần điện tích hạt nhân thì
- A
độ âm điện tăng dần.
- B
độ âm điện không thay đổi.
- C
độ âm điện giảm dần.
- D
độ âm điện tăng lên xong giảm xuống.
Đáp án: C
Lời giải chi tiết:
Trong bảng hệ thống tuần hoàn, trong 1 phân nhóm chính (nhóm A) theo chiều tăng dần điện tích hạt nhân thì độ âm điện giảm dần
Câu hỏi 7 :
Điều khẳng định nào sau đây là đúng ?
- A
Hạt nhân nguyên tử được cấu tạo nên bởi các hạt proton, electron, nơtron.
- B
Trong nguyên tử số hạt proton bằng số hạt electron.
- C
Số khối A bằng tổng số proton (Z) cộng tổng số electron (E).
- D
Nguyên tử có cấu trúc đặc khít, gồm vỏ nguyên tử và hạt nhân nguyên tử.
Đáp án: B
Lời giải chi tiết:
Điều khẳng định đúng là: Trong nguyên tử số hạt proton bằng số hạt electron.
A sai vì: Hạt nhân nguyên tử được cấu tạo nên bởi các hạt proton và nơtron.
C sai vì A = Z + N
D sai vì nguyên tử có cấu trúc rỗng
Câu hỏi 8 :
Ion X có 18 electron và 16 proton, mang điện tích là
- A
18+
- B
2-
- C
18-
- D
2+
Đáp án: B
Phương pháp giải:
+) số e trong nguyên tử = số p
=> điện tích ion = tổng số e - số e trong nguyên tử
Lời giải chi tiết:
Vì X có 16p => trong nguyên tử X có 16 e
Mà trong ion X có 18 e => ion nhiều hơn nguyên tử 2 e
=> mang điện tích 2-
Câu hỏi 9 :
Cho các nguyên tố: X (Z= 11), Y (Z= 17). Liên kết hoá học giữa X và Y thuộc loại...
- A liên kết kim loại.
- B iên kết ion.
- C liên kết cộng hoá trị có cực.
- D liên kết cộng hoá trị không có cực.
Đáp án: B
Phương pháp giải:
Bước 1: Xác định tính kim loại, phi kim của X, Y
Viết cấu hình đầy đủ của X, Y. Từ cấu hình xác định vị trí của X, Y trong bảng tuần hoàn.
Bước 2: Xác định liên kết giữa X, Y
- Liên kết giữa kim loại điển hình và phi kim điển hình là liên kết ion
- Liên kết giữa 2 nguyên tử giống hệt nhau là liên kết cộng hóa trị không phân cực
- Liên kết giữa hai nguyên tố phi kim khác nhau thường thuộc liên kết CHT có cực.
Lời giải chi tiết:
Bước 1: Xác định tính kim loại, phi kim của X, Y
11X: 1s22s22p63s1 => X là kim loại điển hình (nhóm IA)
17Y: 1s22s22p63s23p5 => Y là phi kim điển hình (nhóm VIIA)
Bước 2: Xác định liên kết giữa X, Y
Như vậy liên kết giữa X và Y là liên kết ion
Câu hỏi 10 :
Vỏ nguyên tử là một thành phần của nguyên tử:
- A không mang điện
- B mang điện tích âm
- C mang điện tích dương
- D có thể mang điện hoặc không mang điện
Đáp án: B
Phương pháp giải:
Dựa vào cấu tạo vỏ nguyên tử để chọn đáp án đúng.
Lời giải chi tiết:
Vỏ nguyên tử được tạo thành từ các hạt electron. Do đó vỏ nguyên tử mang điện tích âm.
Câu hỏi 11 :
Trong một nhóm A, bán kính nguyên tử của các nguyên tố:
- A
tăng theo chiều tăng của điện tích hạt nhân.
- B
giảm theo chiều tăng của điện tích hạt nhân.
- C
tăng theo chiều tăng của tính kim loại.
- D
A và C đều đúng.
Đáp án: D
Lời giải chi tiết:
Trong một nhóm A, bán kính nguyên tử của các nguyên tố: tăng theo chiều tăng của điện tích hạt nhân hay tăng theo chiều tăng của tính kim loại.
Câu hỏi 12 :
Để đạt đến trạng thái bền vững theo quy tắc bát tử, nguyên tử Al cần
- A
nhường đi 3e.
- B
nhận vào 5e.
- C
nhường đi 1e.
- D
nhận vào 7e.
Đáp án: A
Lời giải chi tiết:
Cấu hình e của Al: 1s22s22p63s23p1
=> nguyên tử Al cần cho 3e để đạt cấu hình bền vững của Ne (1s22s22p6)
Câu hỏi 13 :
Phản ứng nào sau đây là phản ứng oxi hóa-khử?
- A 2HgO → 2Hg + O2.
- B CaCO3 → CaO + CO2.
- C 2Al(OH)3 → Al2O3 + 3H2O.
- D 2NaHCO3 → Na2CO3 + CO2 + H2O.
Đáp án: A
Phương pháp giải:
Phản ứng oxi hóa khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa
Lời giải chi tiết:
Phản ứng oxi hóa khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa
Chỉ có phản ứng 2HgO → 2Hg + O2 có sự thay đổi số oxi hóa
Câu hỏi 14 :
Một đơn vị khối lượng nguyên tử (u) được định nghĩa là?
- A
Khối lượng của 1 mol nguyên tử đồng vị cacbon 12.
- B
Khối lượng của 1 nguyên tử đồng vị cacbon 12.
- C
1/12 khối lượng của 1 nguyên tử đồng vị cacbon 12.
- D
1/12 khối lượng của 1 nguyên tử cacbon.
Đáp án: C
Phương pháp giải:
Xem lại lí thuyết nguyên tố hóa học – đồng vị
Lời giải chi tiết:
Một đơn vị khối lượng nguyên tử (u) được định nghĩa là: 1/12 khối lượng của 1 nguyên tử đồng vị cacbon 12.
Câu hỏi 15 :
Độ âm điện của một nguyên tử đặc trưng cho:
- A Khả năng tham gia phản ứng mạnh hay yếu của nguyên tử đó.
- B Khả năng nhường electron của nguyên tử đó cho nguyên tử khác.
- C Khả năng nhường proton của nguyên tử đó cho nguyên tử khác.
- D Khả năng hút electron của nguyên tử đó khi hình thành liên kết hoá học.
Đáp án: D
Lời giải chi tiết:
Độ âm điện của một nguyên tử đặc trưng cho khả năng hút electron của nguyên tử đó khi hình thành liên kết hóa học.
Câu hỏi 16 :
Điện hoá trị của canxi (Ca) trong CaCl2 là:
- A
+1.
- B
+2.
- C
-1.
- D
-2.
Đáp án: B
Phương pháp giải:
CaCl2 là hợp chất ion, vì vậy điện hóa trị của Ca bằng điện tích của ion Ca2+
Lời giải chi tiết:
- Trong hợp chất ion, hóa trị của một nguyên tố bằng điện tích của ion và được gọi là điện hóa trị của nguyên tố đó.
- CaCl2 là hợp chất ion, điện tích của canxi trong CaCl2 là +2 => điện hóa trị là +2
Câu hỏi 17 :
Cho các nhận xét sau:
(1) Một nguyên tử có điện tích hạt nhân là +1,6a.10-19 culong thì số proton trong hạt nhân là a.
(2) Trong một nguyên tử thì số proton luôn bằng số nơtron.
(3) Khi bắn phá hạt nhân người ta tìm thấy một loại hạt có khối lượng gần bằng khối lượng của proton, hạt đó là electron.
(4) Trong nguyên tử bất kì thì điện tích của lớp vỏ luôn bằng điện tích của hạt nhân nhưng ngược dấu.
Số nhận xét đúng là:
- A 1
- B 2
- C 3
- D 4
Đáp án: B
Phương pháp giải:
Dựa vào đặc điểm về điện tích và khối lượng của các loại hạt proton, nơtron và electron để tìm nhận xét đúng.
Lời giải chi tiết:
+ 1 proton có điện tích là +1,6.10-19 C → Một nguyên tử có điện tích hạt nhân là +1,6.a.10-19 culong thì số proton trong hạt nhân là (1,6.a.10-19): (1,6.10-19) = a → Nhận xét (1) đúng.
+ Trong 1 nguyên tử thì số proton luôn bằng số electron → Nhận xét (2) sai.
+ Trong hạt nhân gồm proton và nơtron nên bắn phá hạt nhân sẽ không thấy hạt electron → Nhận xét (3) sai.
+ Trong 1 nguyên tử bất kì số p = số e, nếu điện tích của lớp vỏ mang điện tích âm (-Z) thì điện tích của hạt nhân là +Z → Nhận xét (4) đúng.
Vậy có 2 nhận xét đúng.
Câu hỏi 18 :
Kiểu liên kết tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung được gọi là
- A liên kết cộng hóa trị.
- B liên kết ion.
- C liên kết hidro.
- D liên kết kim loại.
Đáp án: A
Lời giải chi tiết:
Liên kết cộng hóa trị được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung.
Câu hỏi 19 :
Hoá trị trong hợp chất ion được gọi là :
- A số oxi hoá.
- B cộng hoá trị.
- C điện hoá trị.
- D điện tích ion.
Đáp án: C
Lời giải chi tiết:
Hóa trị trong hợp chất ion được gọi là điện hóa trị.
Câu hỏi 20 :
Nói về cấu tạo lớp vỏ electron của nguyên tử, phát biểu nào sau đây sai?
- A Lớp thứ hai chứa tối đa 8 electron.
- B Phân lớp d chứa tối đa 5 electron.
- C Phân lớp p chứa tối đa 6 electron.
- D Lớp thứ ba chứa tối đa 18 electron.
Đáp án: B
Phương pháp giải:
Dựa vào quy tắc số electron tối đa trong phân lớp và lớp electron:
+ Lớp thứ n có tối đa 2n2 electron.
+ Phân lớp s có tối đa 2 electron, phân lớp p có tối đa 6 electron, phân lớp d có tối đa 10 electron, phân lớp f có tối đa 14 electron.
Lời giải chi tiết:
Dựa vào quy tắc số electron tối đa trong phân lớp và lớp electron:
+ Lớp thứ n có tối đa 2n2 electron.
+ Phân lớp s có tối đa 2 electron, phân lớp p có tối đa 6 electron, phân lớp d có tối đa 10 electron, phân lớp f có tối đa 14 electron.
- Xét A: Lớp thứ hai có chứa tối đa 2.22 = 8 electron → Phát biểu A đúng.
- Xét B: Phân lớp p có tối đa 6 electron → Phát biểu C đúng.
- Xét C: Phân lớp d chứa tối đa 10 electron →Phát biểu B sai.
- Xét D: Lớp thứ ba có chứa tối đa 2.32 = 18 electron → Phát biểu D đúng.
Câu hỏi 21 :
Chỉ ra nội dung sai :
- A
Số oxi hoá của nguyên tố trong các hợp chất bằng hoá trị của nguyên tố đó.
- B
Trong một phân tử, tổng số oxi hoá của các nguyên tố bằng không.
- C
Số oxi hoá của ion đơn nguyên tử bằng điện tích của ion đó.
- D
Tổng số oxi hoá của các nguyên tố trong ion đa nguyên tử bằng điện tích của ion đó.
Đáp án: A
Lời giải chi tiết:
Câu sai là: Số oxi hoá của nguyên tố trong các hợp chất bằng hoá trị của nguyên tố đó.
Vì trong hợp chất HNO3, N có số oxi hóa +5 còn hóa trị là 4
Câu hỏi 22 :
Cho X có cấu hình e: [Ne]3s23p4. Hỏi X thuộc nguyên tố nào?
- A s
- B p
- C d
- D f
Đáp án: B
Phương pháp giải:
Electron cuối cùng (theo phân mức năng lượng) được điền vào phân lớp nào thì nguyên tố thuộc họ đó.
Lời giải chi tiết:
Ta thấy e cuối cùng được điền vào phân lớp p nên X là nguyên tố p
Câu hỏi 23 :
Hợp chất trong phân tử có liên kết ion là:
- A
NH4Cl.
- B
NH3
- C
HCl
- D
H2O
Đáp án: A
Phương pháp giải:
Liên kết ion là liên kết được tạo thành do lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Lời giải chi tiết:
Liên kết ion là liên kết được tạo thành do lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
A đúng vì:
Câu hỏi 24 :
Tính khối lượng tuyệt đối của một nguyên tử lưu huỳnh (gồm 16 proton, 16 notron, 16 electron)
- A 5,7735.10-26 kg.
- B 7,3573.10-26 kg.
- C 5,3573.10-26 kg.
- D 3,3573.10-26 kg.
Đáp án: C
Phương pháp giải:
mnguyên tử = Z.mp + N.mn + Z.me (với Z là số p = số e; N = số n và mp, mn, me lần lượt là khối lượng của 1 hạt p, n, e.
Lời giải chi tiết:
mtuyệt đối nguyên tử = Z.mp + N.mn + Z.me
= 16.1,6726.10-27 + 16.1,6748.10-27 + 16.9,1094.10-31
= 5,3573.10-26 kg
Câu hỏi 25 :
Nguyên tố Bo có 2 đồng vị 10B ( x1 %) và 11B ( x2 %) nguyên tử khối trung bình của B là 10,8. x1 là
- A 80%
- B 20%
- C 10,8%
- D 89,2%
Đáp án: B
Phương pháp giải:
Áp dụng công thức tính số khối trung bình
Lời giải chi tiết:
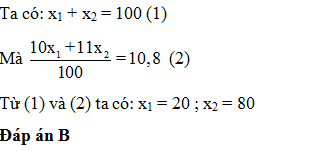
Câu hỏi 26 :
Trong tự nhiên, clo (Cl) có hai đồng vị bền là 35Cl và 37Cl. Mỗi đồng vị đó lần lượt chiếm 75% và 25%. Nguyên tử khối trung bình của clo là:
- A 35.
- B 35,5.
- C 36.
- D 37
Đáp án: B
Phương pháp giải:
Áp dụng công thức số khối trung bình
Lời giải chi tiết:
Xét 1 mol Clo thì có : 0,75 mol 35Cl và 0,25 mol 37Cl
=> Mtb(Cl) = 0,75.35 + 0,25.37 = 35,5g
=>B
Câu hỏi 27 :
Trong anion X─ có tổng số hạt cơ bản là 53, số hạt mang điện chiếm 66,04%. Cấu hình electron của X─ là
- A 1s22s22p6.
- B 1s22s22p63s23p4.
- C 1s22s22p63s23p5.
- D 1s22s22p63s23p6.
Đáp án: D
Phương pháp giải:
Hạt p: Z
Hạt e: Z + 1
Hạt n: N
=> Tổng số hạt: 2Z + N + 1, số hạt mang điện: 2Z + 1
Dựa vào dữ kiện đề bài lập 2 phương trình 2 ẩn và giải
Lời giải chi tiết:
Hạt p: Z
Hạt e: Z + 1
Hạt n: N
=> Tổng số hạt: 2Z + N + 1, số hạt mang điện: 2Z + 1
- Trong anion X─ có tổng số hạt cơ bản là 53=> 2Z + N + 1 = 53 hay 2Z + N = 52 (1)
- Số hạt mang điện chiếm 66,04% => (2Z + 1)/(2Z + N + 1) = 0,6604 hay 0,6792Z – 0,6604N = -0,3396 (2)
Giải (1) và (2) thu được Z = 17 và N = 18
Cấu hình e của X là: 1s22s22p63s23p5
=> Cấu hình e của X-: 1s22s22p63s23p6
Câu hỏi 28 :
Tổng số hạt cơ bản trong nguyên tử của nguyên tố X là 40. X là nguyên tố hóa học nào dưới đây?
- A
Na
- B
P
- C
Al
- D
Si
Đáp án: C
Phương pháp giải:
Điều kiện bền của nguyên tử: số p ≤ số n ≤ 1,5.số p
Lời giải chi tiết:
Tổng hạt = p + e + n = 40 => n = 40 – 2p
Điều kiện bền của nguyên tử: số p ≤ số n ≤ 1,5.số p
=> p ≤ 40 – 2p ≤ 1,5p => 11,42 ≤ p ≤ 13,33
=> p = 12 hoặc p = 13
Với p = 12 => n = 16 => A = 28 (loại vì Si có A = 28 nhưng p = 14)
Với p = 13 => n = 14 => A = 27 (Al)
Câu hỏi 29 :
Nguyên tử của nguyên tố X có tổng số electron trong các phân lớp p là 7. Nguyên tử của nguyên tố Y có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của X là 8. Cấu hình electron lớp ngoài cùng của Y là
- A 3s23p5
- B 2s22p4.
- C 3s23p4.
- D 3s23p3
Đáp án: A
Phương pháp giải:
X có 7 electron p → viết được cấu hình e của X → pX = ?
Dựa vào dữ kiện bài toán suy ra pY = ?. Từ đó viết được cấu hình e của Y
Lời giải chi tiết:
X có 7 electron p → X: 1s22s22p63s23p1 → X có số p = 13
Y có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của X là 8 nên:
2py = 13.2 + 8 → py = 17
→ Y: 1s22s22p63s23p5
Câu hỏi 30 :
Nguyên tử nguyên tố X có tổng số hạt cơ bản là 34 hạt. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 10 hạt. Điện tích hạt nhân của X là:
- A
11
- B
12
- C
13
- D
14
Đáp án: A
Phương pháp giải:
+) Tổng số hạt cơ bản = p + n + e
+) Số hạt mang điện = p + e ; số hạt không mang điện = n
+) p = e
Lời giải chi tiết:
X có : p + n + e = 2p + n = 34
Và : 2p – n = 10
=> p = 11 ; n = 12
Vậy điện tích hạt nhân = 11
Câu hỏi 31 :
Nguyên tố ở chu kỳ 5, nhóm VIA có cấu hình electron hóa trị là
- A
4s24p4.
- B
4s24p5.
- C
5s25p5.
- D
5s25p4.
Đáp án: D
Phương pháp giải:
+) Từ chu kì => số lớp electron
+) Từ số nhóm A => số electron lớp ngoài cùng
Lời giải chi tiết:
Nguyên tố ở chu kỳ 5 => số lớp electron là 5
Nguyên tố thuộc nhóm VIA => có 6e lớp ngoài cùng
=> cấu hình electron hóa trị là 5s25p4.
Câu hỏi 32 :
A và B là hai nguyên tố ở cùng một nhóm và thuộc hai chu kì liên tiếp trong bảng tuần hoàn. Tổng số proton trong hai hạt nhân nguyên tử của A và B bằng 32. Cấu hình electron A là
- A
1s22s22p63s2
- B
1s22s22p63s23p64s2
- C
1s22s22p3
- D
1s22s22p63s23p63d54s2
Đáp án: A
Phương pháp giải:
+) 2 nguyên tố ở 2 chu kì liên tiếp => xét ở chu kì lớn (cách nhau 18e) và chu kì nhỏ (cách nhau 8e)
Trường hợp 1: ZB - ZA = 8
Trường hợp 2: ZB - ZA = 18
Lời giải chi tiết:
A và B là hai nguyên tố ở cùng một phân nhóm và thuộc hai chu kì liên tiếp trong bảng tuần hoàn nên số thứ tự của chúng hơn kém nhau 8 hoặc 18 đơn vị (đúng bằng số nguyên tố trong một chu kỳ).
Theo bài ra, tổng số proton trong hai hạt nhân nguyên tử của A và B bằng 32 nên ZA + ZB = 32.
Trường hợp 1: ZB - ZA = 8. Ta tìm được ZA = 12; ZB = 20.
Cấu hình electron:
A : 1s22s22p63s2 (chu kỳ 3, nhóm IIA).
và B: 1s22s22p63s23p64s2 (chu kỳ 4, nhóm IIA).
Trường hợp 2: ZB - ZA = 18. Ta tìm được ZA = 7; ZB = 25.
Cấu hình electron:
A : 1s22s22p3 (chu kỳ 2, nhóm VA).
và B: 1s22s22p63s23p63d54s2 (chu kỳ 4, nhóm VIIB).
Trường hợp này A, B không cùng nhóm nên không thỏa mãn.
Câu hỏi 33 :
Phần trăm khối lượng của nguyên tố R trong hợp chất khí với hiđro và trong oxit cao nhất tương ứng là a% và b%, với a : b = 11 : 4. Phát biểu nào sau đây là đúng?
- A
Phân tử oxit cao nhất của R không có cực.
- B
Oxit cao nhất của R ở điều kiện thường là chất rắn.
- C
Trong bảng tuần hoàn các nguyên tố hóa học, R thuộc chu kì 3.
- D
Nguyên tử R (ở trạng thái cơ bản) có 6 electron s.
Đáp án: A
Phương pháp giải:
Gọi công thức phân tử của R với H là RHx
=>Công thức oxit cao nhất tương ứng có dạng R2O8-x
+) Từ tỉ lệ a:b => tìm ra quan hệ giữa x và R.
Thử các giá trị x từ 4;5;6 tìm R
=> tìm R và x
Lời giải chi tiết:
Gọi công thức phân tử của R với H là RHx → oxit cao nhất tương ứng có dạng R2O8-x
Ta có: Phần trăm về khối lượng của R trong công thức với Hiđro và trong công thức oxit cao nhất là: $\begin{gathered}a = \dfrac{R}{{R + x}} \cdot 100\% \,\,;\,\,b = \dfrac{{2R}}{{2R + 16.(8 - x)}} \cdot 100\% \, \hfill \\\to \dfrac{a}{b} = \dfrac{{2R + 16.(8 - x)}}{{2(R + x)}} = \dfrac{{11}}{4} \Leftrightarrow 14R + 86x = 512 \to \left\{ \begin{gathered}x = 4 \hfill \\R = 12 \hfill \\ \end{gathered} \right. \hfill \\ \end{gathered} $
→R là cacbon. Oxit cao nhất của C là CO2 : O = C = O (phân tử không phân cực).
→ A đúng
B sai do CO2 ở điều kiện thường là chất khí.
C sai do Cacbon thuộc chu kì 2.
D sai do Cacbon (ở trạng thái cơ bản): 6C: 1s22s22p2 → có 4 electron s và 2 electron p
Câu hỏi 34 :
Cho nguyên tố H (Z = 1) và nguyên tố S (Z = 16). Hợp chất tạo thành từ 2 nguyên tố là
- A
HS
- B
HS2.
- C
H2S.
- D
H2S3
Đáp án: C
Phương pháp giải:
Bước 1: Xác định cấu hình electron các nguyên tử
Bước 2: Xác định số e thiếu để đạt cấu hình bền của khí hiếm => số e góp chung = số e thiếu
Bước 3: Xác định tỉ lệ các nguyên tố dựa vào e góp chung => CTPT
Lời giải chi tiết:
H: 1s1 => góp chung 1e
S: 1s22s22p63s23p4 => góp chung 2e
=> 1 nguyên tử S liên kết với 2 nguyên tử H tạo thành hợp chất H2S
Câu hỏi 35 :
Thực hiện các thí nghiệm sau
a. Nung nóng KNO3
b. Cho Fe(OH)2 vào dung dịch H2SO4 đặc nóng dư
c. Sục khí Cl2 vào dung dịch FeCl2
d. Cho dung dịch KHSO4 vào dung dịch FeCl2
e. Cho Si vào dung dịch NaOH
Sau khi các phản ứng xảy ra, số thí nghiệm xảy ra phản ứng oxi hóa - khử là
- A
3
- B
2
- C
4
- D
5
Đáp án: C
Phương pháp giải:
Viết pthh
Phản ứng oxh khử là phản ứng mà chất tham gia thay đổi số oxh
Lời giải chi tiết:
(a) KNO3 KNO2 + ½ O2 → phản ứng oxh khử
(b) 2Fe(OH)2 + 4H2SO4 đặc Fe2(SO4)3 + SO2 + 6H2O → phản ứng oxh khử
(c) Cl2 + 2FeCl2 → 2FeCl3 → phản ứng oxh khử
(d) KHSO4 + FeCl2 → không phản ứng
(e) Si + 2NaOH + H2O → Na2SiO3 + 2H2 → Phản ứng oxh khử
Số thí nghiệm xảy ra phản ứng oxi hóa khử là 4
Câu hỏi 36 :
Hòa tan 12,6 gam Fe bằng dung dịch H2SO4 loãng dư, thu được dung dịch X. Dung dịch X phản ứng vừa đủ với V ml dung dịch KMnO4 0,5M. Giá trị của V là
- A 180.
- B 90
- C 45
- D 135
Đáp án: B
Phương pháp giải:
HS có thể giải theo cách viết PTHH hoặc theo phương pháp bảo toàn e.
Lời giải chi tiết:
Cách 1:
\(\begin{gathered}
Fe + {H_2}S{O_4} \to FeS{O_4} + {H_2} \hfill \\
0,225\,\,\,\,\,\,\,\,\,\, \to \,\,\,\,\,\,\,0,225\,\,\,\,\,\,\,\,\,\,\,\,\,(mol) \hfill \\
10FeS{O_4} + 2KMn{O_4} + 8{H_2}S{O_4} \to 5F{e_2}{(S{O_4})_3} + 2MnS{O_4} + {K_2}S{O_4} + 8{H_2}O \hfill \\
0,225\,\,\,\,\,\,\,\,\, \to 0,045(mol) \hfill \\
\end{gathered} \)
Cách 2:
\(Fe\xrightarrow{{{H_2}S{O_4}\,loang}}\mathop {Fe}\limits^{ + 2} \xrightarrow{{KMn{O_4}}}\mathop {Fe}\limits^{ + 3} \)
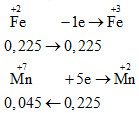
=> V dd KMnO4 = 0,045 : 0,5 = 0,09 lít = 90 ml
Câu hỏi 37 :
Hòa tan hoàn toàn m gam hỗn hợp gồm ba kim loại bằng dung dịch HNO3 thu được 1,12 lít hỗn hợp khí X (đktc) gồm NO2 và NO. Tỉ khối hơi của X so với hiđro bằng 18,2. Thể tích tối thiểu dung dịch HNO3 37,8% (d = 1,242 g/ml) cần dùng là
- A
20,18 ml.
- B
11,12 ml.
- C
21,47 ml.
- D
36,7 ml
Đáp án: C
Phương pháp giải:
Gọi số mol của NO2 và NO là a, b
Lập hpt tìm a, b
Áp dụng công thức:
\(\begin{gathered}{n_{HN{O_3}}} = 2{n_{N{O_2}}} + 4{n_{NO}} \hfill \\C\% = \dfrac{{{m_{ct}}}}{{{m_{{\text{dd}}}}}}.100 \hfill \\d = \dfrac{{{m_{{\text{dd}}}}}}{{{v_{{\text{dd}}}}}} \hfill \\ \end{gathered} \)
Lời giải chi tiết:
Gọi số mol của NO2 và NO là a, b
Ta có: \(\left\{ \begin{gathered}a + b = 0,05 \hfill \\ \dfrac{{46a + 30b}}{{(a + b)}} = 18,2.\,\,2 \hfill \\ \end{gathered} \right. = > \left\{ \begin{gathered}a = 0,02 \hfill \\b = 0,03 \hfill \\ \end{gathered} \right.\)
nHNO3 = 2n NO2 + 4n NO = 0,16 mol
\({v_{{\text{dd}}}} = \dfrac{{{m_{HN{O_3}}}.100}}{{C\% .d}} = \dfrac{{0,16.\,\,63.\,\,100}}{{37,8.\,\,1,242}} = 21,47ml\)
Câu hỏi 38 :
Cho 16,3 gam hỗn hợp 2 kim loại thuộc nhóm IA và ở 2 chu kì kế tiếp vào nước dư thu được 5,6 lít H2 ở đktc và dung dịch X. Tên của 2 kim loại là:
- A
Li và Na
- B
Na và K
- C
K và Rb
- D
Li và K
Đáp án: B
Phương pháp giải:
đặt công thức trung bình của 2 kim loại là \(\overline{M}\)thì \(\overline{2M}+2{{H}_{2}}O\to 2\overline{M}OH+{{H}_{2}}\)
Tính số mol trung bình rồi tính được M trung bình
Lời giải chi tiết:
đặt công thức trung bình của 2 kim loại là \(\overline{M}\)thì
\(\overline{2M}+2{{H}_{2}}O\to 2\overline{M}OH+{{H}_{2}}\)
Số mol khí H2 là 5,6 :22,4 =0,25 mol
Nên số mol của \(\overline{M}\) là 0,5 mol
Suy ra \(\overline{M}\)=16,3 : 0,5=32,6
Vậy 2 kim loại là Na va K
Câu hỏi 39 :
Trong anion XY32- có 30 proton. Trong nguyên tử X cũng như Y có số proton bằng số notron. X và Y là nguyên tố nào sau đây?
- A C và O
- B S và O
- C Si và O
- D C và S
Đáp án: A
Phương pháp giải:
Ta có: PX + 3.PY= 30.
Khi đó số proton trung bình bằng P = 30 : 4= 7,5
Do đó phải có 1 chất có số proton nhỏ hơn 7,5.
Xét các trường hợp để tìm PX và PY thích hợp.
Lời giải chi tiết:
Ta có: PX + 3.PY= 30.
Khi đó số proton trung bình bằng P = 30 : 4= 7,5
Do đó phải có 1 chất có số proton nhỏ hơn 7,5.
Thử các trường hợp ta được PX= 6 và PY= 8
Ta có PX= NX suy ra PX= NX= 6 → X là nguyên tố C
Ta có PY= NY suy ra PY= NY = 8 → Y là nguyên tố O
Câu hỏi 40 :
Hợp chất M được tạo thành từ cation X+ và anion Y3-. Mỗi ion đều do 5 nguyên tử của hai nguyên tố phi kim tạo nên. Tổng số p trong X+ là 11, trong Y3- là 47. Hai nguyên tố trong Y3- thuộc 2 chu kì kế tiếp trong bảng tuần hoàn và cách nhau 7 đơn vị. Công thức hợp chất M là
- A
(NH4)2CrO4
- B
(CH4)2SO4
- C
(NH4)3PO4
- D
(NH4)2S2O3
Đáp án: C
Phương pháp giải:
Đặt A, B là hai nguyên tố tạo ra cation X+
+) Từ dữ kiện tổng số p trong X+ là 11, biện luận tìm A và B
Đặt D, E là hai nguyên tố tạo ra anion Y3-
+) Từ dữ kiện số p trong Y3- là 47 và 2 nguyên tố trong Y3- thuộc 2 chu kì kế tiếp trong bảng tuần hoàn và cách nhau 7 đơn vị => lập hpt tìm số p của D, E
Lời giải chi tiết:
Đặt A, B là hai nguyên tố tạo ra cation X+
+) X+ có dạng AB4+ => pA + 4.pB = 11
=> pA = 7 (N) và pB = 1 (H), thỏa mãn NH4+, loại nghiệm pA = 3 (Li) và pB = 2 (He) do Li là kim loại và He là khí hiếm
+) Tương tự A2B3+ => 2.pA + 3.pB = 11 => vô nghiệm
Đặt D, E là hai nguyên tố tạo ra anion Y3-
+) Y3- có dạng: DE43- => pD + 4.pE = 47
Theo đề: Hai nguyên tố trong Y3- thuộc 2 chu kì kế tiếp trong bảng tuần hoàn và cách nhau 7 đơn vị
=> pD + 7 = pE hoặc pD – 7 = pE
=> pD = 15 và pE = 8
=> Y3- là PO43-
+) Làm tương tự cho D2E33-, vô nghiệm
Vậy M là (NH4)3PO4
