I. Bản chất dòng điện trong chất điện phân
1. Thuyết điện li
Trong dung dịch, các hợp chất hóa học như axit, bazơ và muối bị phân li (một phần hoặc toàn bộ) thành các nguyên tử (hoặc nhóm nguyên tử) tích điện gọi là ion; ion có thể chuyển động tự do trong dung dịch và trở thành hạt tải điện.
Video mô phỏng truyền dẫn điện phân
2. Bản chất dòng điện trong chất điện phân
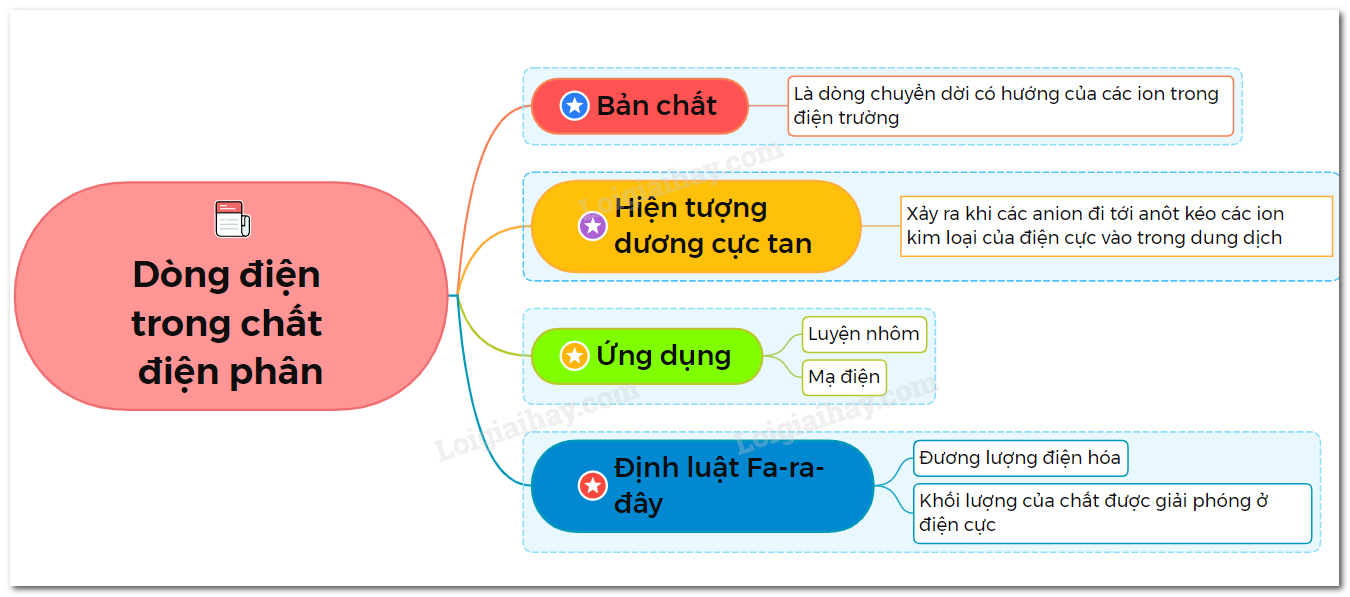
- Dòng điện trong chất điện phân là dòng ion dương và ion âm chuyển động có hướng theo hai chiều ngược nhau.
+ Ion dương chạy về phía catôt nên gọi là cation
+ Ion âm chạy về phía anôt nên gọi là anion.
- Dòng điện trong chất điện phân không chỉ tải điện lượng mà còn tải cả vật chất (theo nghĩa hẹp) đi theo. Tới điện cực chỉ có êlectron có thể đi tiếp, còn lượng vật chất đọng lại ở điện cực, gây ra hiện tượng điện phân.
- Chất điện phân không dẫn điện tốt bằng kim loại.
II. Các hiện tượng diễn ra ở điện cực. Hiện tượng dương cực tan
Ta xét chi tiết những gì xảy ra ở điện cực của bình điện phân dung dịch CuSO4 có điện cực bằng đồng bình điện phân này thuộc loại đơn giản nhất, vì chất tan là muối của kim loại dùng làm điện cực (trường hợp này là đồng)
Khi dòng điện chạy qua, cation Cu2+ chạy về catôt, về nhận electron từ nguồn điện đi tới. Ta có ở các điện cực:
+ Ở catốt: Cu2+ + 2e- → Cu
+ Ở anốt: Cu → Cu2+ + 2e-
Khi anion (SO4)2- chạy về anôt, nó kéo ion Cu2+ vào dung dịch. Như vậy, đồng ở anôt sẽ tan dần vào trong dung dịch. Đó là hiện tượng dương cực tan.
Vậy:
- Các ion chuyển động về các điện cực có thể tác dụng với chất làm điện cực hoặc với dung môi tạo nên các phản ứng hóa học gọi là phản ứng phụ trong hiện tượng điện phân.
- Hiện tượng dương cực tan xảy ra khi các anion đi tới anot kéo các ion kim loại của điện cực vào trong dung dịch.
III. Các định luật Fa-Ra-Đây
Vì dòng điện trong chất điện phân tải điện lượng cùng với vật chất (theo nghĩa hẹp) nên khối lượng chất đi đến điện cực:
- Tỉ lệ thuận với điện lượng chạy qua bình điện phân
- Tỉ lệ thuận với khố lượng của ion (hay khối lượng mol nguyên tử A của nguyên tố tạo nên ion ấy);
- Tỉ lệ nghịch với điện tích của ion (hay hoá trị n của nguyên tố tạo ra ion ấy)
1. Định luật Fa-ra-đây thứ nhất
Khối lượng vật chất được giải phóng ở điện cực của bình điện phân tỉ lệ thuận với điện lượng chạy qua bình đó
m = kq
k gọi là đương lượng điện hoá của chất được giải phóng ở điện cực.
2. Định luật Fa-ra-đây thứ hai
Đương lượng điện hoá k của một nguyên tố tỉ lệ với đương lượng gam \( \frac{A}{n}\) của nguyên tố đó. Hệ số tỉ lệ là \( \frac{1}{F}\), trong đó F gọi là số Fa-ra-đây
k = \( \frac{1}{F}\).\( \frac{A}{n}\)
Thí nghiệm cho thấy, nếu I tính bằng ampe, t tính bằng giây thì:
F = 96 494 C/mol
* Kết hợp hai định luật Fa-ra-đây, ta được công thức Fa-ra-đây:
m = \( \frac{1}{F}\).\( \frac{A}{n}\).It
m là lượng chất được giải phóng ở điện cực, tính bằng gam.
IV. Ứng dụng của hiện tượng điện phân
Một số ứng dụng của hiện tượng điện phân:
- Điều chế hoá chất: điều chế clo, hiđrô và xút trong công nghiệp hoá chất.
- Luyện kim: người ta dựa vào hiện tượng dương cực tan để tinh chế kim loại. Các kim loại như đồng, nhôm, magiê và nhiều hoá chất được điều trực tiếp bằng phương pháp điện phân
- Mạ điện: người ta dùng phương pháp điện phân để phủ một lớp kim loại không gỉ như crôm, niken, vàng, bạc... lên những đồ vật bằng kim loại khác.
Sơ đồ tư duy về dòng điện trong chất điện phân