Bài tập tr 26 1
|
Những phát biểu sau nói về đặc điểm của các hạt cấu tạo nên nguyên tử. Với mỗi phát biểu, hãy điền tên hạt phù hợp vào ô trống.
|
Phương pháp giải:
Các nguyên tử có cùng số hạt proton thì thuộc cùng 1 nguyên tố
Cấu tạo nguyên tử gồm:
- Vỏ nguyên tử: 1 hay nhiều electron mang điện tích âm, có khối lượng = 0,00055 amu, có thể bỏ qua khi tính khối lượng nguyên tử
- Hạt nhân nguyên tử:
+ Proton: mang điện tích dương, có khối lượng = 1 amu
+ Neutron: không mang điện, có khối lượng = 1 amu
Lời giải chi tiết:
|
Phát biểu |
Loại hạt |
|
(1) Hạt mang điện tích dương |
Proton |
|
(2) Hạt được tìm thấy cùng với proton trong hạt nhân |
Neutron |
|
(3) Hạt có thể xuất hiện với số lượng khác nhau trong các nguyên tử của cùng một nguyên tố |
Neutron |
|
(4) Hạt có trong lớp vỏ xung quanh hạt nhân |
Electron |
|
(5) Hạt mang điện tích âm |
Electron |
|
(6) Hạt có khối lượng rất nhỏ, có thể bỏ qua khi tính khối lượng nguyên tử |
Electron |
|
(7) Hạt không mang điện tích |
Neutron |
Bài tập tr 26 2
|
Điền thông tin thích hợp vào chỗ… trong mỗi câu sau: a) Hạt nhân của nguyên tử được cấu tạo bởi các hạt…(?)… b) Một nguyên tử có 17 proton trong hạt nhân, số electron chuyển động quanh hạt nhân là…(?)… c) Một nguyên tử có 10 electron, số proton trong hạt nhân của nguyên tử đó là…(?)… d) Khối lượng nguyên tử nguyên tố X bằng 19 amu, số electron của nguyên tử đó là 9. Số neutron của nguyên tử X là…(?)… e) Một nguyên tử có 3 proton, 4 neutron và 3 electron. Khối lượng của nguyên tử đó là…(?)… |
Phương pháp giải:
- Nguyên tử gồm:
+ Lớp vỏ: 1 hay nhiều electron mang điện tích âm
+ Hạt nhân gồm: neutron (không mang điện) và proton (mang điện tích dương)
- Trong 1 nguyên tử, số proton = số electron
- Khối lượng nguyên tử = khối lượng hạt nhân = số proton + số neutron
Lời giải chi tiết:
a) Hạt nhân của nguyên tử được cấu tạo bởi các hạt proton và neutron
b) Một nguyên tử có 17 proton trong hạt nhân, số electron chuyển động quanh hạt nhân là 17
c) Một nguyên tử có 10 electron, số proton trong hạt nhân của nguyên tử đó là 10
d) Khối lượng nguyên tử nguyên tố X bằng 19 amu, số electron của nguyên tử đó là 9. Số neutron của nguyên tử X là 10
e) Một nguyên tử có 3 proton, 4 neutron và 3 electron. Khối lượng của nguyên tử đó là 7 amu
Bài tập tr 26 3
|
Viết kí hiệu hóa học của các nguyên tố sau: hydrogen, helium, carbon, nito, oxygen, natri |
Phương pháp giải:
Tham khảo bảng 2.1:
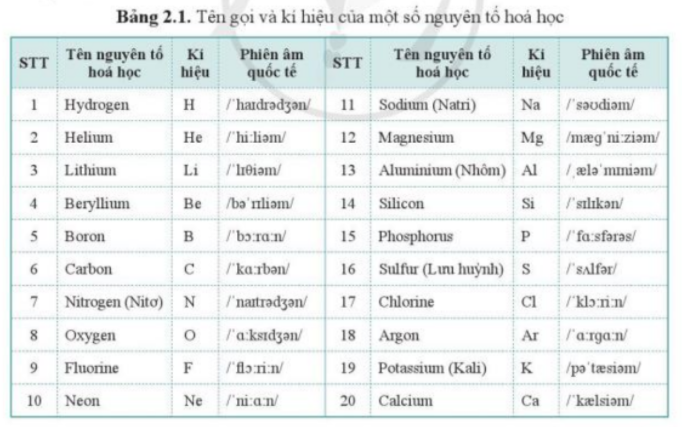
Lời giải chi tiết:
|
Tên nguyên tố hóa học |
Kí hiệu hóa học |
|
Hydrogen |
H |
|
Helium |
He |
|
Carbon |
C |
|
Nito |
N |
|
Oxygen |
O |
|
Natri |
Na |
Bài tập tr 26 4
|
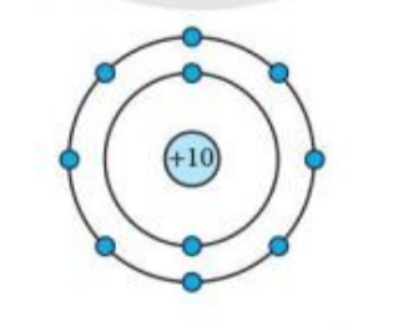
Mô hình sắp xếp electron trong nguyên tử của nguyên tố X như sau:
a) Trong nguyên tử X có bao nhiêu electron và được sắp xếp thành mấy lớp? b) Hãy cho biết tên nguyên tố X c) Gọi tên một nguyên tố khác mà nguyên tử của nó có cùng số lớp electron với nguyên tử nguyên tố X |
Phương pháp giải:
a) Số electron = số hình tròn nhỏ màu xanh, số lớp electron = số đường tròn xung quanh hạt nhân
b) Dựa vào bảng tuần hoàn hóa học trang 25
c) Dựa vào bảng tuần hoàn trang 25: các nguyên tử nằm trên cùng 1 hàng có cùng số chu kì và số lớp electron
Lời giải chi tiết:
a) Mô hình cấu tạo nguyên tử X có: 10 hình tròn nhỏ màu xanh, 2 đường tròn xung quanh hạt nhân
=> Nguyên tử X có 10 electron và có 2 lớp electron
b) Nguyên tử X có điện tích hạt nhân = +10
=> STT của X trong bảng tuần hoàn là 10
=> X là Neon
c)
Nguyên tố X có 2 lớp electron => Nằm ở chu kì 2 của bảng tuần hoàn
=> Nguyên tố cùng nằm ở chu kì 2 là: Oxygen, Nitrogen, Carbon…
Bài tập tr 27 5
|
Hoàn thành những thông tin còn thiếu trong bảng sau:
|
||||||||||||||||||||||||||||||||||||||||
Phương pháp giải:
- Dựa vào bảng tuần hoàn trang 25: từ số proton tìm ra được tên nguyên tố và kí hiệu hóa học của chúng (số proton = số hiệu nguyên tử = số thứ tự ô trong bảng tuần hoàn)
- Cách tính số proton:
+ Số electron = số proton
+ Khối lượng nguyên tử = số proton + số neutron
Lời giải chi tiết:
- Hàng thứ 1: Số proton = số electron = 9, khối lượng nguyên tử = 10 + 9 =19, tên nguyên tố là fluorine, kí hiệu hóa học: F
- Hàng thứ 2: Số proton = số electron = 16, số neutron = 32 – 16 = 16, kí hiệu hóa học: S
- Hàng thứ 3: Số proton = số electron = 12, số neutron = 24 – 12 = 12, tên nguyên tố là Magnesium, kí hiệu hóa học: Mg
- Hàng thứ 4: Số proton = số electron = 1, số neutron = 2 – 1 = 1, tên nguyên tố là Hydrogen, kí hiệu hóa học: H
- Hàng thứ 5: Số proton = số electron = 11, số neutron = 23 – 11 = 12, tên nguyên tố là Sodium, kí hiệu hóa học: Na
|
Tên nguyên tố |
Kí hiệu hóa học |
Nguyên tử của nguyên tố |
|||
|
Số proton |
Số neutron |
Số electron |
Khối lượng nguyên tử (amu) |
||
|
Fluorine |
F |
9 |
10 |
9 |
19 |
|
Lưu huỳnh |
S |
16 |
16 |
16 |
32 |
|
Magnesium |
Mg |
12 |
12 |
12 |
24 |
|
Hydrogen |
H |
1 |
1 |
1 |
2 |
|
Sodium (natri) |
Na |
11 |
12 |
11 |
23 |
Bài tập tr 27 6
|
Số proton và số neutron của hai nguyên tử X và Y được cho trong bảng sau:
a) Tính khối lượng của nguyên tử X và nguyên tử Y b) Nguyên tử X và nguyên tử Y có thuộc cùng một nguyên tố hóa học không? Vì sao? |
Phương pháp giải:
a) Khối lượng nguyên tử = khối lượng hạt nhân = số proton + số neutron
b) Các nguyên tử có cùng số proton trong hạt nhân thì thuộc cùng 1 nguyên tố hóa học
Lời giải chi tiết:
a)
- Xét nguyên tử X có 6 proton và 6 neutron
=> Khối lượng nguyên tử X = 6 + 6 = 12 amu
- Xét nguyên tử Y có 6 proton và 8 neutron
=> Khối lượng nguyên tử Y = 6 + 8 = 14 amu
b) Nguyên tử X và nguyên tử Y đều có 6 proton trong hạt nhân
=> Nguyên tử X và nguyên tử Y đều thuộc 1 nguyên tố hóa học
Bài tập tr 27 7
|
Cho các nguyên tố sau: Ca, S, Na, Mg, F, Ne. Sử dụng bảng tuần hoàn các nguyên tố hóa học: a) Hãy sắp xếp các nguyên tố trên theo chiều tăng dần điện tích hạt nhân b) Cho biết mỗi nguyên tố trong dãy trên là kim loại, phi kim hay khí hiếm |
Phương pháp giải:
a) Số thứ tự ô trong bảng tuần hoàn = số proton = đơn vị điện tích hạt nhân = số hiệu nguyên tử
b) Dựa vào màu sắc của ô trong bảng tuần hoàn trang 25:
+ Màu xanh: kim loại
+ Màu hồng: phi kim
+ Màu vàng: khí hiếm
Lời giải chi tiết:
a)
|
Kí hiệu hóa học |
Điện tích hạt nhân |
|
Ca |
+20 |
|
S |
+16 |
|
Na |
+11 |
|
Mg |
+12 |
|
F |
+9 |
|
Ne |
+10 |
=> Các nguyên tố theo chiều tăng dần điện tích hạt nhân: F, Ne, Na, Mg, S, Ca
b) Ca: Kim loại
S: Phi kim
Na: Kim loại
Mg: Kim loại
F: Phi kim
Ne: Khí hiếm
Bài tập tr 27 8
|
Dựa vào bảng tuần hoàn, hãy cho biết một số thông tin của các nguyên tố có số hiệu nguyên tử lần lượt là 12, 15, 18. Điền các thông tin theo mẫu bảng sau:
|
Phương pháp giải:
- Dựa vào bảng tuần hoàn trang 25
+ Số hiệu nguyên tử = số thứ tự ô => Tên nguyên tố, kí hiệu hóa học, khối lượng nguyên tử
+ Số thứ tự hàng => Số chu kì
+ Tên nhóm: ở phía trên mỗi cột
+ Màu sắc ô => kim loại, phi kim hay khí hiếm
Lời giải chi tiết:
- Số hiệu nguyên tử là 12:
+ Tên nguyên tố: Magnesium (Mg), khối lượng nguyên tử là 24
+ Nằm ở hàng 3 => Chu kì 3
+ Nhóm IIA
+ Màu xanh => Kim loại
- Số hiệu nguyên tử là: 15
+ Tên nguyên tố: Phosphorus (P), khối lượng nguyên tử là 31
+ Nằm ở hàng 3 => Chu kì 3
+ Nhóm VA
+ Màu hồng => Phi kim
- Số hiệu nguyên tử là: 18
+ Tên nguyên tố: Argon (Ar), khối lượng nguyên tử là 40
+ Nằm ở hàng 3 => Chu kì 3
+ Nhóm VIIIA
+ Màu vàng => Khí hiếm
|
Số hiệu nguyên tử |
Tên nguyên tố |
Kí hiệu hóa học |
Khối lượng nguyên tử |
Chu kì |
Nhóm |
Kim loại, phi kim hay khí hiếm |
|
12 |
Magnesium |
Mg |
24 |
3 |
IIA |
Kim loại |
|
15 |
Phosphorus |
P |
31 |
3 |
VA |
Phi kim |
|
18 |
Argon |
Ar |
40 |
3 |
VIIIA |
Khí hiếm |
Bài tập tr 27 9
|
Biết nguyên tử của nguyên tố M có 2 electron ở lớp ngoài cùng và có 3 lớp electron. Hãy xác định vị trí của M trong bảng tuần hoàn (ô, chu kì, nhóm) và cho biết M là kim loại, phi kim hay khí hiếm |
Phương pháp giải:
- Số electron lớp ngoài cùng = số thứ tự của nhóm A
- Số lớp electron = số thứ tự chu kì
=> Xác định được vị trí
- Màu sắc của ô để xác định là kim loại, phi kim hay khí hiếm
Lời giải chi tiết:
- Nguyên tử M có 2 electron ở lớp ngoài cùng => M nằm ở nhóm IIA
- Nguyên tử M có 3 lớp electron => M nằm ở chu kì 3
=> M thuộc ô số 12, nằm ở nhóm IIA, chu kì 3
- Ô số 12 màu xanh => Nguyên tử M là kim loại