Câu hỏi 1 :
Cho các phản ứng :
(a) Ca(OH)2 + CO2 → CaCO3 + H2O
(b) 2H2S + SO2 → 3S + 2H2O
(c) 2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O
(d) 4KClO3 → KCl + 3KClO4
Số phản ứng oxi hóa - khử là :
- A 2
- B 4
- C 3
- D 1
Đáp án: C
Phương pháp giải:
Dựa vào khái niệm về phản ứng oxi hóa – khử: Phản ứng oxi hóa – khử là phản ứng có sự thay đổi số oxi hóa của một số nguyên tố.
Lời giải chi tiết:
Các phản ứng oxi hóa – khử là (b), (c), (d)
Câu hỏi 2 :
Chất nào dưới đây thể hiện tính khử khi cho tác dụng với dung dịch H2SO4 loãng?
- A
Fe.
- B
Fe(OH)2.
- C
FeO.
- D
FeCl3.
Đáp án: A
Phương pháp giải:
Chất khử là chất nhường e để lên mức oxi hóa cao hơn.
Lời giải chi tiết:
Chất khử là chất nhường e để lên mức oxi hóa cao hơn.
Fe + H2SO4 → FeSO4 + H2 => Fe thể hiện tính khử
Câu hỏi 3 :
Phát biểu nào dưới đây không đúng?
- A Sự oxi hóa là sự mất (nhường) electron
- B Sự khử là sự mất electron hay cho electron
- C Chất khử là chất nhường (cho) electron
- D Chất oxi hóa là chất thu electron
Đáp án: B
Phương pháp giải:
Nắm được khái niệm:
+ Chất khử là chất nhường e
+ Chất oxi hóa là chất nhận e
+ Sự khử là sự nhận e
+ Sự oxi hóa là sự nhường e
Lời giải chi tiết:
B sai vì sự khử là sự nhận e
Câu hỏi 4 :
Cho phản ứng: Mg + H2SO4 → MgSO4 + S + H2O. Tổng hệ số cân bằng là:
- A 18
- B 16
- C 20
- D 15
Đáp án: D
Phương pháp giải:
Cân bằng phản ứng oxi hóa – khử bằng phương pháp thăng bằng electron.
Lời giải chi tiết:
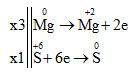
3Mg + 4H2SO4 → 3MgSO4 + S + 4H2O
Tổng hệ số cân bằng là: 3 + 4 + 3 + 1 + 4 = 15
Câu hỏi 5 :
Phản ứng nào dưới đây thuộc loại phản ứng oxi hóa khử?
- A NaOH + HBr → NaBr + H2O.
- B 3NO2 + H2O → 2HNO3 + NO.
- C Al4C3 + 12H2O → 4Al(OH)3 + 3CH4.
- D O3 → O2 + O.
Đáp án: B
Phương pháp giải:
Phản ứng oxi hóa khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của nguyên tố.
Lời giải chi tiết:
\(3\mathop N\limits^{ + 4} {O_2} + {H_2}O \to 2H\mathop N\limits^{ + 5} {O_3} + \mathop N\limits^{ + 2} O\)
Câu hỏi 6 :
Dấu hiệu để nhận biết một phản ứng oxi hóa – khử là:
- A Có tạo ra chất khí.
- B Có sự thay đổi số oxi hóa của một số nguyên tố.
- C Có sự thay đổi màu sắc của các chất.
- D Có tạo ra chất kết tủa.
Đáp án: B
Lời giải chi tiết:
Phản ứng oxi hóa khử là phản ứng có sự thay đổi số oxi hóa của một số nguyên tố.
Câu hỏi 7 :
Cho phương trình hóa học : 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3. Kết luận nào sau đây là đúng?
- A
Fe(OH)2 là chất khử, H2O là chất oxi hoá.
- B
Fe(OH)2 là chất khử, O2 là chất oxi hoá.
- C
O2 là chất khử, H2O là chất oxi hoá.
- D
Fe(OH)2 là chất khử, O2 và H2O là chất oxi hoá
Đáp án: B
Lời giải chi tiết:
$4\overset{+2}{\mathop{Fe}}\,{{\left( OH \right)}_{2}}~+~{{\overset{0}{\mathop{O}}\,}_{2}}~+\text{ }2{{H}_{2}}O\text{ }\to \text{ }4\overset{+3}{\mathop{Fe}}\,{{(\overset{-2}{\mathop{O}}\,H)}_{3}}.$
Quá trình cho – nhận e:
$\overset{+2}{\mathop{Fe}}\,~\,\,\to \text{ }\overset{+3}{\mathop{Fe}}\,\,\,+\,\,1\text{e}$ => Fe(OH)2 là chất khử
${{\overset{0}{\mathop{O}}\,}_{2}}~+\text{ 4e }\to \text{ 2}\overset{-2}{\mathop{O}}\,$ => O2 là chất oxi hóa
Câu hỏi 8 :
Cho quá trình sau: $\overset{+\text{3}}{\mathop{\text{Fe}}}\,$ + 1e → $\overset{+\text{2}}{\mathop{\text{Fe}}}\,$. Trong các kết luận sau, kết luận nào là đúng?
- A
Quá trình trên là quá trình oxi hóa.
- B
Quá trình trên là quá trình khử.
- C
Trong quá trình trên $\overset{+\text{3}}{\mathop{\text{Fe}}}\,$ đóng vai trò là chất khử.
- D
Trong quá trình trên $\overset{+\text{2}}{\mathop{\text{Fe}}}\,$ đóng vai trò là chất oxi hóa.
Đáp án: B
Lời giải chi tiết:
Quá trình nhận electron gọi là quá trình khử (sự khử)
Câu hỏi 9 :
Cho amoniac NH3 tác dụng với oxi ở nhiệt độ cao có xúc tác thích hợp sinh ra nitơ oxit NO và nước. Phương trình hoá học: 4NH3 + 5O2 → 4NO + 6H2O. Trong phản ứng trên, NH3 đóng vai trò
- A
là chất oxi hoá.
- B
là chất khử.
- C
là một bazơ.
- D
là một axit.
Đáp án: B
Lời giải chi tiết:
$4\overset{-3}{\mathop{N}}\,{{H}_{3}}+\text{ }5{{\overset{0}{\mathop{O}}\,}_{2}}\to 4\overset{+2}{\mathop{N}}\,\overset{-2}{\mathop{O}}\,\text{ }+\text{ }6{{H}_{2}}O$
Quá trình cho – nhận e của N:
$\mathop N\limits^{ - 3} {\mkern 1mu} {H_3}{\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\text{}} \to {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} \mathop N\limits^{ + 2} {\mkern 1mu} O{\mkern 1mu} {\mkern 1mu} $ + 5e
=> NH3 đóng vai trò là chất khử.
Câu hỏi 10 :
Cho sơ đồ phản ứng: FeS2 + HNO3 → Fe(NO3)3 + H2SO4 + 5NO + H2O
Sau khi cân bằng, tổng hệ số cân bằng của phản ứng là
- A 25
- B 21
- C 23
- D 19
Đáp án: D
Phương pháp giải:
Cân bằng phản ứng oxi hóa khử theo phương pháp thăng bằng electron.
FeS2 + 8HNO3 → Fe(NO3)3 + 2H2SO4 + 5NO + 2H2O
Tổng hệ số cân bằng của phản ứng là: 1 + 8 + 1 + 2 + 5 + 2 = 19
Đáp án D
Lời giải chi tiết:
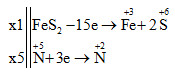
FeS2 + 8HNO3 → Fe(NO3)3 + 2H2SO4 + 5NO + 2H2O
Tổng hệ số cân bằng của phản ứng là: 1 + 8 + 1 + 2 + 5 + 2 = 19
Câu hỏi 11 :
Cho khí CO dư đi qua ống sứ chứa Fe2O3 và MgO nung nóng, sau khi phản ứng xảy ra hoàn toàn thu dược chất rắn X. Cho X vào dung dịch FeCl3 và CuCl2, thu được chất rắn Y. Cho Y tác dụng với dung dịch HCl dư, thu được dung dịch Z chứa ba chất tan. Dãy gồm các chất nào sau đây khi tác dụng với Z đều có phản ứng xảy ra pahrn ứng oxi hóa - khử?
- A Cl2, NaOH, K2Cr2O7.
- B AgNO3, Cl2, KNO3.
- C H2S, NaOH, AgNO3.
- D AgNO3, NH3, KMnO4.
Đáp án: B
Phương pháp giải:
Sơ đồ:\(CO + \left\{ \matrix{
F{e_2}{O_3} \hfill \cr
MgO \hfill \cr} \right.\buildrel {{t^0}} \over
\longrightarrow X\left\{ \matrix{
Fe \hfill \cr
MgO \hfill \cr} \right.\buildrel { + FeC{l_3},CuC{l_2}} \over
\longrightarrow ran\,Y\left\{ \matrix{
Fe \hfill \cr
Cu \hfill \cr
MgO \hfill \cr} \right.\buildrel { + HCl\,du} \over
\longrightarrow ddZ\left\{ \matrix{
FeC{l_2} \hfill \cr
MgC{l_2} \hfill \cr
HCldu \hfill \cr} \right.\)
Dựa vào đáp án chọn đáp án phù hợp
Lời giải chi tiết:
\(CO + \left\{ \matrix{
F{e_2}{O_3} \hfill \cr
MgO \hfill \cr} \right.\buildrel {{t^0}} \over
\longrightarrow X\left\{ \matrix{
Fe \hfill \cr
MgO \hfill \cr} \right.\buildrel { + FeC{l_3},CuC{l_2}} \over
\longrightarrow rắn\,Y\left\{ \matrix{
Fe \hfill \cr
Cu \hfill \cr
MgO \hfill \cr} \right.\buildrel { + HCl\,dư} \over
\longrightarrow ddZ\left\{ \matrix{
FeC{l_2} \hfill \cr
MgC{l_2} \hfill \cr
HCldu \hfill \cr} \right.\)
A. Loại NaOH không có phản ứng oxh- khử
B. Thỏa mãn
Ag+ + Fe2+ → Fe3+ + Ag↓
3Fe2+ + NO3- + 4H+ → 3Fe3+ + NO + 2H2O
Cl2 + Fe2+ → Fe3+ + Cl-
C. Loại NaOH không có phản ứng oxh- khử
D. Loại NH3 không có phản ứng oxh- khử
Câu hỏi 12 :
Cho phản ứng: KMnO4 + FeSO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O
Hệ số của chất oxi hóa và chất khử trong phản ứng trên lần lượt là
- A 5 và 1.
- B 2 và 10.
- C 1 và 5.
- D 5 và 2.
Đáp án: B
Phương pháp giải:
Cân bằng phản ứng oxi hóa khử bằng phương pháp thăng bằng electron.
Chất khử là chất cho e, chất oxi hóa là chất nhận e.
Lời giải chi tiết:
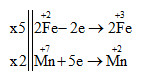
2KMnO4 + 10FeSO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Chất oxi hóa là KMnO4 có hệ số là 2
Chất khử là FeSO4 có hệ số là 10
Câu hỏi 13 :
Ở phản ứng nào sau đây, H2O không đóng vai trò chất oxi hoá hay chất khử?
- A
NaH + H2O → NaOH + H2
- B
2Na + 2H2O → 2NaOH + H2
- C
2F2 + 2H2O → 4HF + O2
- D
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
Đáp án: D
Phương pháp giải:
Xem lại định nghĩa phản ứng oxi hóa – khử (c3)
Lời giải chi tiết:
H2O không đóng vai trò chất oxi hoá hay chất khử => H2O không thay đổi số oxi hóa
$A{{l}_{4}}{{C}_{3}}+\text{ }12{{\overset{+1}{\mathop{H}}\,}_{2}}\overset{-2}{\mathop{O}}\,\to 4Al{{(\overset{-2}{\mathop{O}}\,\overset{+1}{\mathop{H}}\,)}_{3}}+\text{ }3C{{\overset{+1}{\mathop{H}}\,}_{4}}$
Câu hỏi 14 :
Cho phản ứng: aCu + bHNO3 → cCu(NO3)2 + dNO + eH2O
Với a, b, c, d, e là những số nguyên tối giản. Tổng (a+b) bằng?
- A 5
- B 8
- C 11
- D 12
Đáp án: C
Phương pháp giải:
Cân bằng phản ứng oxi hóa khử theo phương pháp thăng bằng e.
Lời giải chi tiết:
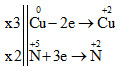
Vậy 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Tổng a + b = 3 + 8 = 11
Câu hỏi 15 :
Dấu hiệu để nhận biết một phản ứng oxi hóa – khử là
- A tạo ra chất khí.
- B tạo ra chất kết tủa.
- C có sự thay đổi màu sắc của các chất.
- D có sự thay đổi số oxi hóa của một số nguyên tố.
Đáp án: D
Lời giải chi tiết:
Phản ứng oxi hóa khử là phản ứng có sự thay đổi số oxi hóa của một hay nhiều nguyên tố.
Câu hỏi 16 :
Chọn phát biểu đúng trong các phát biểu sau ?
- A Chất oxi hóa là chất nhường electron.
- B Quá trình nhận electron là quá trình oxi hóa.
- C Chất khử là chất nhận electron.
- D Quá trình nhường electron là quá trình oxi hóa.
Đáp án: D
Phương pháp giải:
- Ghi nhớ câu “khử cho – o nhận”
+ Chất khử là chất cho e (bị oxi hóa)
+ Chất oxi hóa là chất nhận e (bị khử)
- Quá trình cho e là quá trình oxi hóa, quá trình nhận e là quá trình khử.
Lời giải chi tiết:
Phát biểu đúng là “quá trình nhường electron là quá trình oxi hóa.”
Câu hỏi 17 :
Trong phản ứng : Cl2 + 2KBr → Br2 + 2KCl, nguyên tố clo…
- A chỉ bị khử.
- B không bị oxi hóa, không bị khử.
- C chỉ bị oxi hóa.
- D vừa bị oxi hóa, vừa bị khử.
Đáp án: A
Phương pháp giải:
- Xác định số oxi hóa của Cl trước và sau phản ứng
- Xác định vai trò của Cl:
+ Chất nhường e là chất khử
+ Chất nhận e là chất oxi hóa
Lời giải chi tiết:
\(C{l_2} + 2e \to 2\mathop {Cl}\limits^{ - 1} \)
Cl2 nhận e nên là chất oxi hóa
Câu hỏi 18 :
Quá trình nào sau đây là đúng
- A \(\;\mathop {Al}\limits^0 + 3e\; \to \mathop {Al}\limits^{ + 3} \)
- B \(\;\mathop {Mn}\limits^{ + 7} + 4e\; \to \mathop {Mn}\limits^{ + 4} \)
- C \(\;\mathop S\limits^{ - 2} \; \to \mathop S\limits^0 + 2e\)
- D \(\;\mathop {Mn}\limits^{ + 4} + 3e\; \to \mathop {Mn}\limits^{ + 7} \)
Đáp án: C
Lời giải chi tiết:
Quá trình đúng là: \(\;\mathop S\limits^{ - 2} \; \to \mathop S\limits^0 + 2e\)
Câu hỏi 19 :
Cho quá trình NO3- + 3e + 4H+ → NO + 2H2O, đây là quá trình
- A nhận proton.
- B oxi hóa.
- C khử.
- D tự oxi hóa – khử.
Đáp án: C
Lời giải chi tiết:
Ta thấy quá trình trên là quá trình nhận e nên là quá trình khử.
Câu hỏi 20 :
Dấu hiệu để nhận biết một phản ứng oxi hóa khử:
- A Tạo ra chất kết tủa
- B Tạo ra chất khí
- C Có sự thay đổi màu sắc của các chất
- D Có sự thay đổi số oxi hóa của một số nguyên tử
Đáp án: D
Lời giải chi tiết:
Phản ứng oxi hóa - khử là phản ứng có sự thay đổi số oxi hóa của một số nguyên tố
Câu hỏi 21 :
Trong các phản ứng hóa học, SO2 có thể là chất oxi hoá hoặc chất khử vì
- A
lưu huỳnh trong SO2 đã đạt số oxi hóa cao nhất.
- B
SO2 là oxit axit.
- C
lưu huỳnh trong SO2 có số oxi hóa trung gian.
- D
SO2 tan được trong nước.
Đáp án: C
Phương pháp giải:
Chất khử cho e, chất oxi hóa nhận e => chất vừa có khả năng cho e, vừa có khả năng nhận e
Lời giải chi tiết:
SO2 có thể là chất oxi hoá hoặc chất khử vì lưu huỳnh trong SO2 có số oxi hóa trung gian.
Câu hỏi 22 :
Cho các chất và ion sau: Zn, S, FeO, ZnO, SO2, Fe2+, Cu2+, HCl. Tổng số phân tử và ion trong dãy vừa có tính oxi hóa, vừa có tính khử là
- A
5.
- B
6.
- C
7.
- D
8.
Đáp án: A
Phương pháp giải:
Xem lại định nghĩa chất oxi hóa – khử
Lời giải chi tiết:
Có 5 chất và ion vừa có tính oxi hóa và tính khử là: S, FeO, SO2, Fe2+, HCl
Câu hỏi 23 :
Loại phản ứng nào sau đây luôn không phải là phản úng oxi hóa – khử ?
- A Phản ứng phân hủy
- B Phản ứng trao đổi
- C Phản ứng thế trong hóa học vô cơ
- D Phản ứng hóa học
Đáp án: B
Lời giải chi tiết:
Phản ứng trao đổi không phải là phản ứng oxi hóa - khử.
Câu hỏi 24 :
Hòa tan 12,6 gam Fe bằng dung dịch H2SO4 loãng dư, thu được dung dịch X. Dung dịch X phản ứng vừa đủ với V ml dung dịch KMnO4 0,5M. Giá trị của V là
- A 180.
- B 90
- C 45
- D 135
Đáp án: B
Phương pháp giải:
HS có thể giải theo cách viết PTHH hoặc theo phương pháp bảo toàn e.
Lời giải chi tiết:
Cách 1:
\(\begin{gathered}
Fe + {H_2}S{O_4} \to FeS{O_4} + {H_2} \hfill \\
0,225\,\,\,\,\,\,\,\,\,\, \to \,\,\,\,\,\,\,0,225\,\,\,\,\,\,\,\,\,\,\,\,\,(mol) \hfill \\
10FeS{O_4} + 2KMn{O_4} + 8{H_2}S{O_4} \to 5F{e_2}{(S{O_4})_3} + 2MnS{O_4} + {K_2}S{O_4} + 8{H_2}O \hfill \\
0,225\,\,\,\,\,\,\,\,\, \to 0,045(mol) \hfill \\
\end{gathered} \)
Cách 2:
\(Fe\xrightarrow{{{H_2}S{O_4}\,loang}}\mathop {Fe}\limits^{ + 2} \xrightarrow{{KMn{O_4}}}\mathop {Fe}\limits^{ + 3} \)
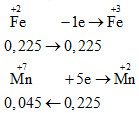
=> V dd KMnO4 = 0,045 : 0,5 = 0,09 lít = 90 ml
Câu hỏi 25 :
Trong phản ứng đốt cháy CuFeS2 tạo ra các sản phẩm CuO, Fe2O3 và SO2 thì 1 phân tử CuFeS2 sẽ
- A
nhường 13e.
- B
nhận 12e.
- C
nhận 13e.
- D
nhường 12e.
Đáp án: A
Lời giải chi tiết:
Xét quá trình cho e:
$CuF\text{e}{{\text{S}}_{2}}\,\,\to \,\,\overset{+2}{\mathop{Cu}}\,O+{{\overset{+3}{\mathop{F\text{e}}}\,}_{2}}{{O}_{3}}+\overset{+4}{\mathop{S}}\,{{O}_{2}}+12\text{e}$
Ta có bán phản ứng: CuFeS2 → Cu2+ + Fe3+ + 2S4+ + 13e
Vậy 1 phân tử CuFeS2 nhường 13e
Câu hỏi 26 :
Cho 29,6 gam hỗn hợp X gồm Fe, Mg, Cu theo tỉ lệ mol 1 : 2 : 3 bằng H2SO4 đặc nguội được dung dịch Y và 11,2 lít SO2 (đktc). Cô cạn dung dịch Y được khối lượng muối khan là
- A
72 gam
- B
21,2 gam
- C
43,4 gam
- D
36,5 gam
Đáp án: A
Phương pháp giải:
Gọi x là số mol Fe trong hỗn hợp X => nMg = 2x, nCu = 3x
=> 56x + 24.2x + 64.3x = 29,6 => x = 0,1 mol
+) Do axit H2SO4 đặc nguội, nên sắt không phản ứng.
+) SO42- + 2e → S+4 => tính số mol e trao đổi => số mol gốc SO42-
+) mmuối = mCu + mMg + ${{m}_{SO_{4}^{2-}}}$
Lời giải chi tiết:
Gọi x là số mol Fe trong hỗn hợp X => nMg = 2x, nCu = 3x
=> 56x + 24.2x + 64.3x = 29,6 => x = 0,1 mol
=> nFe = 0,1 mol, nMg = 0,2 mol, nCu = 0,3 mol
Do axit H2SO4 đặc nguội, nên sắt không phản ứng.
SO42- + 2e → S+4
1 → $\frac{11.2}{22,4}$
=> mmuối = mCu + mMg + ${{m}_{SO_{4}^{2-}}}$ = mCu + mMg + 96.$\frac{1}{2}\sum{{}}$etrao đổi
= 64.0,3 + 24.0,2 + 96.$\frac{1}{2}$1 = 72 gam
Câu hỏi 27 :
Một hỗn hợp gồm hai bột kim loại Mg và Al được chia thành hai phần bằng nhau:
- Phần 1: cho tác dụng với HCl dư thu được 3,36 lít H2.
- Phần 2: hoà tan hết trong HNO3 loãng dư thu được V lít một khí không màu, hoá nâu trong không khí .
Biết các thể tích khí đều đo ở đktc, giá trị của V là
- A
2,24 lít.
- B
3,36 lít.
- C
4,48 lít.
- D
5,6 lít.
Đáp án: A
Phương pháp giải:
+) Bảo toàn e: ne cho = ne nhận = $2.{{n}_{{{H}_{2}}}}$
+) ne cho (phần 2) = ne cho (phần 1)
+) Bảo toàn e: ne cho (phần 2) = 3.nNO => nNO
Lời giải chi tiết:
Phần 1: ${{n}_{{{H}_{2}}}}=0,15\,\,mol$
Bảo toàn e: ne cho = ne nhận = $2.{{n}_{{{H}_{2}}}}=0,3\,\,mol$
Vì số mol của Mg và Al ở 2 phần bằng nhau và Mg, Al phản ứng với HCl hay với HNO3 đều có số oxi hóa như nhau
=> ne cho (phần 2) = ne cho (phần 1) = 0,3 mol
Phần 2: khí không màu, hóa nâu trong không khí là NO
Bảo toàn e: ne cho (phần 2) = 3.nNO => nNO = 0,3 / 3 = 0,1 mol
=> VNO = 0,1.22,4 = 2,24 lít
Câu hỏi 28 :
Điện phân nóng chảy muối clorua kim loại kiềm, thu được 0,896 lít khí (đktc) và 3,12 gam kim loại. Công thức của muối là:
- A
LiCl
- B
KCl
- C
NaCl
- D
RbCl
Đáp án: B
Phương pháp giải:
Đặt công thức muối là MCl
tính theo phương trình hóa học rồi tìm nguyên tử khối của kim loại
Lời giải chi tiết:
Đặt CTHH của muối là MCl
Thì ta có: \(2MCl\xrightarrow{dpnc}2M+C{{l}_{2}}\)
Ta có số mol khí Cl2 là 0,04 mol
Suy ra số mol kim loại là 0,08 mol
Vì thế M = \(\frac{3,12}{0,08}\) = 39 (K)
Câu hỏi 29 :
Cho 15,2 gam hỗn hợp X gồm Mg và Ca phản ứng vừa đủ với 8,96 lít (đktc) hỗn hợp khí Y gồm Cl2 và O2 thu được 39,7 gam chất rắn Z chỉ gồm các muối clorua và các oxit kim loại. Khối lượng của Mg trong 15,2 gam X là
- A 4,8 gam.
- B 7,2 gam.
- C 9,2 gam.
- D 3,6 gam.
Đáp án: B
Phương pháp giải:
Bảo toàn khối lượng, bảo toàn e.
Lời giải chi tiết:
Đặt nCl2 = x; nO2 = y (mol)
BTKL: mY= mZ – mX = 39,7 – 15,2 = 24,5 (g)
Ta có hệ:
\(\left\{ \begin{gathered}
x + y = 0,4 \hfill \\
71x + 32y = 24,5 \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
x = 0,3 \hfill \\
y = 0,1 \hfill \\
\end{gathered} \right.\)
Đặt nMg = a; nCa = b (mol)
Ta có hệ:
\(\left\{ \begin{gathered}
{m_{Mg}} + {m_{Ca}} = {m_X} \hfill \\
\xrightarrow{{BT:e}}2{n_{Mg}} + 2{n_{Ca}} = 2{n_{C{l_2}}} + 4{n_{{O_2}}} \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
24a + 40b = 15,2 \hfill \\
2a + 2b = 2.0,3 + 4.0,1 \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
a = 0,3 \hfill \\
b = 0,2 \hfill \\
\end{gathered} \right.\)
=> mMg = 0,3.24 = 7,2 (g)
Câu hỏi 30 :
Hòa tan hoàn toàn m gam Al vào dung dịch HNO3 loãng, dư thu được 1,344 lít khí N2 (đktc) và dung dịch X. Thêm NaOH dư vào dung dịch X và đun sôi thì thu được 1,344 lít khí NH3 (đktc). Giá trị của m là:
- A
0,54
- B
1,62
- C
10,08
- D
9,72
Đáp án: D
Phương pháp giải:
bảo toàn electron
Lời giải chi tiết:
Vì khi cho NaOH vào dd X thì tạo ra khí NH3 nên phản ứng tạo muối NH4NO3
Ta có sơ đồ:
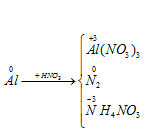
Quá trình cho e: Al → Al+3 + 3e
Quá trình nhận e: 2N+5 +10e → N2
N+5 + 8e → N-3
Số mol khí N2 là 0,06 mol
Số mol khí NH3 là 0,06 mol
Ta có NH4NO3 + NaOH → NaNO3 + NH3 +H2O
Số mol NH4NO3 là 0,06 mol
Áp dụng định luật bảo toàn e thì 3nAl = 10.0,06 + 8.0,06 => nAl = 0,36 mol
Khối lượng của Al là 0,36.27 = 9,72 gam
