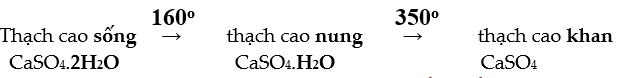VỊ TRÍ KIM LOẠI TRONG BẢNG HỆ THỐNG TUẦN HOÀN . CẤU TẠO CỦA KIM LOẠI
I. VỊ TRÍ
- Nhóm IA(-H), IIA, IIIA(-B), một phần nhóm IVA, VA,VIA
- Các nhóm B (IB→VIIIB)
- Họ lantan và actini (2 hàng cuối BTH)
II. CẤU TẠO KIM LOẠI
1. Cấu tạo nguyên tử: 1→3e lớp ngoài cùng , bán kính nguyên tử tương đối lớn so với phi kim
2. Cấu tạo tinh thể :
Trong mạng tinh thể Kim loại có : Nguyên tử kim loại , Ion kim loại ở nút mạng và các electron tự do .
3. Liên kết kim loại: Liên kết được hình thành giữa các nguyên tử kim loại và ion kim loại do sự tham gia của các electron tự do .
-------------------------------------------------
TÍNH CHẤT CỦA KIM LOẠI – DÃY ĐIỆN HÓA CỦA KIM LOẠI
I. TÍNH CHẤT VẬT LÍ
1. Tính chất vật lí chung: 4 tính chất = dẻo + dẫn điện + dẫn nhiệt + ánh kim
2. Nguyên nhân: do e tự do gây ra
Chú ý:
- to càng cao → dẫn điện giảm (do ion dương cản trở e)
- Vàng (dẻo nhất), Bạc (dẫn điện tốt nhất), Thủy ngân (thể lỏng, to thấp nhất), W (tonc cao nhất), Cr (cứng nhất)
- Khả năng dẫn điện: Ag > Cu > Au > Al > Fe
II. TÍNH CHẤT HÓA HỌC :
Tính khử = Nhường e = Bị oxi hóa
Nguyên nhân: Ít e lớp ngoài cùng + Bán kính lớn + Lực liên kết hạt nhân yếu.
1. Tác dụng với phi kim (Cl2,O2,S)
Kim loại tác dụng với một số phi kim ở nhiệt độ thường
Hg + S → HgS Li + N2 → Li3N
2. Tác dụng với axit
a. dd HCl, H2SO4 loãng (kim loại trước H2) → Muối (Số oxh thấp) + H2
b. dd HNO3, H2SO4 đặc(tất cả kim loai trừ Au, Pt) → Muối (Số oxh cao) + Sp khử + H2O
Thường:
* KL + HNO3 loãng → muối nitrat + NO(ko màu, dễ hóa nâu/KK) + H2O
3M + 4nHNO3 loãng →3M(NO3)n + nNO + 2nH2O
* KL + HNO3 đặc → muối nitrat + NO2(màu nâu) + H2O
M + 2nHNO3 loãng → M(NO3)n + nNO2 + nH2O
* KL + H2SO4 đ,n → muối sunfat + SO2(ko màu,hắc) + H2O
2R + 2nH2SO4 đ,n → R2(SO4)n + nSO2 +2nH2O
Chú ý: Al, Fe, Cr thụ động trong HNO3 và H2SO4 đặc nguội
3. Tác dụng với nước: Kim loại IA + IIA(trừ Be,Mg) + H2O → dd bazơ + H2
M(IA) + H2O→MOH + H2
M(Ca,Ba, Sr) + 2H2O → M(OH)2 + H2
4. Tác dụng với dd muối
- Kim loại (không tan trong nước) đẩy được kim loại yếu hơn ra khỏi muối.
- Kim loại( tan trong nước) thì không đẩy được kim loại yếu ra khỏi muối mà xảy ra theo nhiều giai đoạn:
+ Phản ứng với nước → dd bazơ
+ dd bazơ phản ứng trao đổi với dd muối ( nếu sau phản ứng có kết tủa)
+ Nếu kết tủa có tính lưỡng tính thì tiếp tục tan.
5.Tác dụng với dung dịch bazơ: Al, Zn tan được trong dung dịch bazơ → H2
Al+ NaOH + H2O → NaAlO2 + 3/2 H2
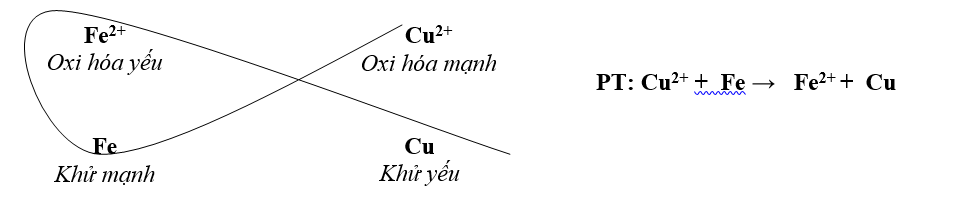
III. DÃY ĐIỆN HÓA
- Nguyên tắc sắp xếp: Từ trái sang phải
+ Tính khử kim loại giảm dần
+ Tính oxi hóa ion kim loại tăng dần
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Cr3+ Fe2+ Ni2+ Sn2+ Pb2+ H+ Cu2+ Fe3+ Ag+ Au3+
Chiều phản ứng: Chất oxi hóa mạnh + Chất khử mạnh → Chất oxi hóa yếu + Chất khử yếu
Ý nghĩa : dự đoán chiều của phản ứng giữa 2 cặp oxi hóa- khử theo quy tắc α
-------------------------------------------
SỰ ĂN MÒN KIM LOẠI
I. KHÁI NIỆM : Là sự phá hủy kim loại hoặc hợp kim do tác dụng các chất trong môi trường xung quanh
II. CÁC DẠNG ĂN MÒN KIM LOẠI : Có 2 dạng ăn mòn kim loại: hóa học và điện hóa
1. Ăn mòn hóa học:quá trình oxi hóa khử, do sự tác động của O2 và H2O ở nhiệt độ cao, electron chuyển trực tiếp vào môi trường
2. Ăn mòn điện hóa
* Khái niệm: quá trình oxi hóa khử, do tác dụng chất điện li→tạo dòng e di chuyển từ cực âm đến cực dương.
* Điều kiện ăn mòn: (hội tụ đủ 3 điều kiện)
- Có 2 điện cực khác chất ( 2 KL khác nhau , KL-PK , KL- hợp chất ..)
- 2 điện cực tiếp xúc với nhau (trực tiếp hoặc gián tiếp)
- Đặt trong môi trường chất điện li (dung dịch ; không khí ẩm cũng là môi trường điện li)
* Cơ chế ăn mòn:
- Kim loại mạnh bị ăn mòn tại cực âm Anot (quá trình OXH)
M → Mn+ + n e
- Kim loại yếu (hoặc PK) là cực dương Catot (quá trình Khử)
2H+ + 2e→ H2
O2 + 2H2O + 4e→ 4OH-
Tóm lại:
- Đối với ăn mòn điện hóa thì kim loại mạnh bị ăn mòn và kim loại càng nguyên chất thì càng khó bị ăn mòn.
- Nếu như ăn mòn hóa học không có dòng điện thì ăn mòn điện hóa có phát sinh dòng điện và quá trình ăn mòn sẽ diễn ra nhanh hơn.
III. CHỐNG ĂN MÒN KIM LOẠI
Có 2 cách chống ăn mòn:
1. Bảo vệ bề mặt: bôi, sơn, mạ, tráng….
2. Phương pháp điện hóa: Dùng kim loại hoạt động hơn để bảo vệ (kim loại hoạt động hơn sẽ bị ăn mòn trước)
Vd: Vỏ tàu biển bằng thép được gắn vào các khối kẽm( lúc này Zn bị ăn mòn trước sắt, khi các khối Zn bị ăn mòn đáng kể rồi, thì sẽ thay bằng các khối Zn khác)
--------------------------------------------------
ĐIỀU CHẾ KIM LOẠI
I. NGUYÊN TẮC: Khử ion kim loại thành kim loại:
Mn+ + ne → M (kim loại)
II. PHƯƠNG PHÁP. (3 phương pháp chính)
1. Nhiệt luyện
- Nguyên tắc: Dùng chất khử mạnh (C,CO, H2, Al) để khử kim loại trong oxit (Từ Zn →Cu)
- Ứng dụng: Điều chế kim loại hoạt động trung bình (Từ Zn →Cu)
- Vd : 4CO + Fe3O4 → 3Fe + 4CO2
2. Thủy luyện
- Nguyên tắc: Dùng kim loại có tính khử mạnh khử ion của kim loại yếu hơn ra khỏi muối
- Ứng dụng: Điều chế kim loại hoạt động trung bình và yếu
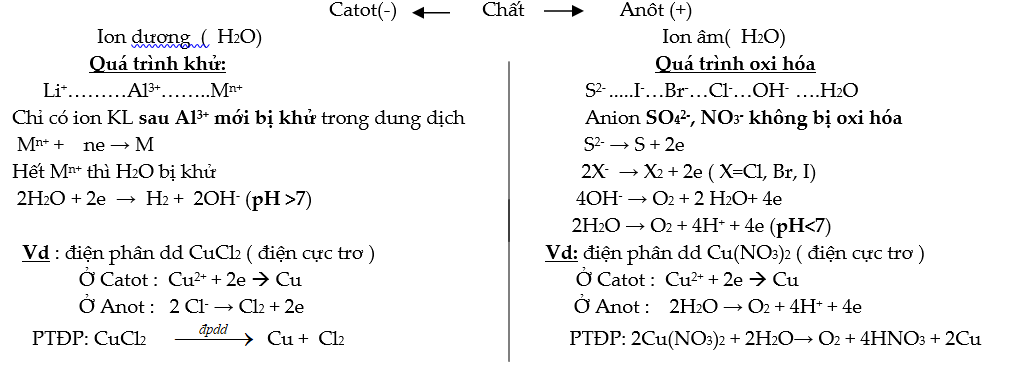
3. Điện phân
- Khử ion kim loại bằng dòng điện một chiều
- Catot ( cực âm ): xảy ra quá trình khử = khử cation → thu được kim loại
- Anot ( cực dương) : xảy ra quá trình oxi hóa → thu được chất khí
a. Điện phân nóng chảy: Điều chế kim loại mạnh (IA, IIA, Al)
b. Điện phân dung dịch: Điều chế kim loại hoạt động trung bình hoặc yếu
Kiến thức cần nhớ:
* Nhớ định luật Faraday tính khối lượng các chất thoát ra ở các điện cực.
m = A.I.t / 96500.n
Trong đó: m: khối lượng chất thoát ra ở điện cực ; A: Khối lượng mol nguyên tử
n: Số e trao đổi; I: Cường độ dòng điện (ampe); t: Thời gian điện phân (giây)
--------------------------------------------------
KIM LOẠI KIỀM
I. VỊ TRÍ – CẤU HÌNH ELECTRON
- Vị trí: Nhóm IA = Li Na K Rb Cs Fr (phóng xạ)
- Cấu hình: ...ns1
II. TÍNH CHẤT VẬT LÍ.
- to sôi, to nóng chảy, khối lượng riêng nhỏ, độ cứng thấp
- Nguyên nhân: cấu tạo tinh thể lập phương tâm khối(rỗng) + liên kết kim loại yếu
III. TÍNH CHẤT HÓA HỌC
- Tính khử rất mạnh: M → M+(số oxi hóa +1)+ 1 e; - Tính khử tăng dần từ Li → Cs
1. Tác dụng với phi kim: Phản ứng xảy ra dễ dàng
2. Tác dụng với axit: Mãnh liệt + nổ
M + HCl → NaCl + 1/2H2
3. Tác dụng với nước: Mãnh liệt + nổ
M + H2O → MOH + 1/2H2
Chú ý: Do kim loại kiềm dễ phản ứng với oxi, nước → ngâm trong dầu hỏa để bảo quản.
IV.ỨNG DỤNG – TRẠNG THÁI TỰ NHIÊN – ĐIỀU CHẾ.
1. Ứng dụng: Dùng trong thiết bị báo cháy, tổng hợp chất hữu cơ; Na, K là chất trao đổi nhiệt trong lò phản ứng hạt nhân, điều chế kim loại hiếm bằng phản ứng nhiệt luyện, Cs làm tế bào quang điện
2. Trạng thái tự nhiên: Dạng hợp chất nước biển, đất …
3. Điều chế: Điện phân nóng chảy muối halogen (hoặc hidroxit)
2 MX → 2 M + X2
--------------------------------------------------
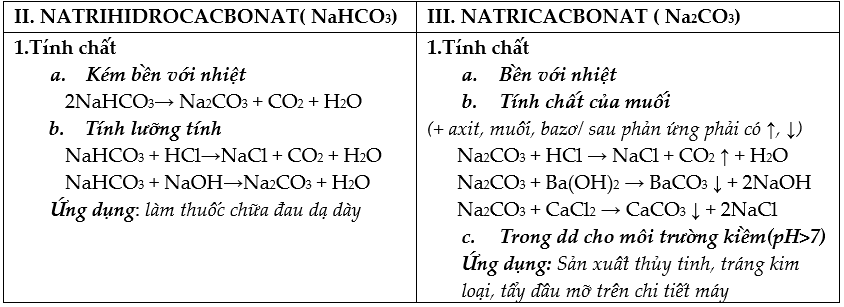
HỢP CHẤT KIM LOẠI KIỀM (NaOH, Na2CO3, NaHCO3)
I. NATRIHIDROXIT: NaOH
1. Tính chất
- Phân li hoàn toàn → môi trường bazơ (pH>7)
Tính chất của bazơ (mạnh)
+ Tác dụng được oxit axit: CO2, SO2,…
CO2 + NaOH → NaHCO3 hoặc CO2 + 2NaOH → Na2CO3 + H2O
+ Tác dụng với axit: HCl, H2SO4, HNO3,…
HCl + NaOH → NaCl + H2O
+ Tác dụng với dd muối: (phản ứng phải sinh ra kết tủa):
vd: CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
KIM LOẠI KIỀM THỔ
I. VỊ TRÍ – CẤU HÌNH ELECTRON
- Vị trí: IIA = Be Mg Ca Sr Ba Ra(phóng xạ)
- Cấu hình: …ns2
II. TÍNH CHẤT VẬT LÍ
- to sôi, to nóng chảy, khối lượng riêng thấp ( cao hơn KLK ) biến đổi không theo quy luật
- Nguyên nhân: Cấu tạo mạng tinh thể khác nhau:Be,Mg (lục phương); Ca, Sr (lập phương tâm diện);Ba (lập phương tâm khối)
III. TÍNH CHẤT HÓA HỌC
- Tính khử mạnh: M → M2+ + 2e tính khử tăng dần từ Be→Ba
1. Tác dụng với phi kim(Cl2, O2, S)
2. Tác dụng với axit
a. HCl, H2SO4 loãng → muối + H2
Mg + 2HCl → MgCl2 + H2
b. H2SO4 đặc, HNO3→ muối + sản phẩm khử + H2O
KL kiềm thổ có khả năng khử S+6(SO42-) xuống S-2 (H2S), So và N+5(NO3-) xuống N-3(NH4NO3)...
4Mg + 10HNO3 → 4Mg(NO3)2 + NH4NO3 + 3H2O
4Mg + 5H2SO4 → 4MgSO4 + H2S + 4H2O
3. Tác dụng với nước:
- to thường: Be không phản ứng, Mg p/ư chậm
- Kim loại còn lại phản ứng mạnh : M + 2H2O → M(OH)2 + H2
4. Tác dụng với oxit: Mg + CO2 → MgO + CO (không dùng CO2 để dập tắt đám cháy Mg)
IV. ĐIỀU CHẾ: Điện phân nóng chảy muối halogen : MX2 → M + X2
V. ỨNG DỤNG: Be dùng làm hợp kim giúp vật liệu tăng độ bền, độ đàn hồi;
Mg tạo hợp kim cứng, bền nhẹ, chế tạo tên lửa, ô tô,…
--------------------------------------------------
HỢP CHẤT QUAN TRỌNG CỦA CANXI
I. CANXI HDROXIT
- Ca(OH)2 rắn (vôi tôi), dung dịch tan trong nước gọi là nước vôi trong
- Ca(OH)2 có tính chất một bazơ ( quỳ tím hóa xanh , tác dụng axit , oxit axit , dd muối )
Ca(OH)2 + CO2 → CaCO3 + H2O (nhận biết khí CO2)
Ứng dụng: Sx NH3, clorua vôi (CaOCl2), vật liệu xây dựng
II. CANXI CABONAT
- Bị phân hủy ở 1000oC:
CaCO3 → CaO(vôi sống) + CO2 ( pứ xảy ra trong quá trình nung vôi )
- CaCO3 tan được trong nước khi có mặt CO2
CaCO3 + CO2 + H2O → Ca(HCO3)2 (chỉ tồn tại trong dung dịch)
→ giải thích hiện tượng thạch nhũ trong hang động
- Trong tự nhiên CaCO3 có ở: đá vôi, đá hoa, đá phấn, vỏ các loài ốc, sò,...
- Ứng dụng: nhiều trong xây dựng, sản xuất ximăng
III. CANXI SUNFAT: Canxi sunfat = thạch cao
--------------------------------------------------
NƯỚC CỨNG
I. KHÁI NIỆM: Nước chứa nhiều ion Ca2+, Mg2+
II. PHÂN LOẠI ( 3 loại)
1. Tạm thời: Chứa anion HCO3- → chứa 2 muối Ca(HCO3)2 và Mg(HCO3)2
Tạm thời vì: đun sôi muối phân hủy làm mất độ cứng của nước
2. Vĩnh cửu: Chứa anion: Cl-, SO42- → chứa 4 muối: CaCl2, MgCl2, CaSO4, MgSO4
3. Toàn phần = tạm thời + Vĩnh cửu
III. TÁC HẠI
- Tốn nhiên liệu gây nổ
- Giảm lưu lượng nước trong ống dẫn
- Tốn xà phòng, quần áo mau hư
- Giảm hương vị của trà, nấu lâu chín và giảm mùi thức ăn.
IV. CÁCH LÀM MỀM NƯỚC CỨNG
1. Nguyên tắc: Giảm nồng độ ion Ca2+, Mg2+
2. Phương pháp
a. Phương pháp kết tủa
* Đối với tính cứng tạm thời :
- Đun → mất độ cứng tạm thời :
Ca(HCO3)2 → CaCO3 + CO2 + H2O
- Dùng hóa chất: Ca(OH)2 vừa đủ , Na2CO3, Na3PO4
* Đối với tính cứng vĩnh cửu ( toàn phần ) :
Dùng hóa chất: Na2CO3, Na3PO4
b. Phương pháp trao đổi ion
--------------------------------------------------
NHÔM
I. VỊ TRÍ – CẤU HÌNH ELETRON
- Vị trí: Ô: 13; Chu kỳ: 3; Nhóm: IIIA ; - Cấu hình: [Ne] 3s23p1
II. TÍNH CHẤT HÓA HỌC
- Tính khử mạnh (chỉ sau KL nhóm IA, IIA) ;
- Nhường 3e: M → M3+ + 3e
1. Tác dụng với phi kim (O2, Cl2 ...)
2Al + 3Cl2 → 2AlCl3 ; 4Al + 3O2 → 2Al2O3 (to)
Chú ý: Al bền trong không khí do có lớp màng oxit (Al2O3) bảo vệ
2. Tác dụng với axit
a. HCl, H2SO4 loãng → muối + H2
2Al + 6HCl → 2AlCl3 + 3H2 ;
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
b.H2SO4 đặc, nóng; HNO3 → muối + sản phẩm khử + H2O
Chú ý: Al thu động trong H2SO4 và HNO3 đặc nguội
3. Tác dụng với oxit kim loại (phản ứng nhiệt nhôm)
2Al + Fe2O3 → Al2O3 + 2Fe (Ứng dụng phản ứng này hàn đường ray)
4. Tác dụng với nước
- Al không phản ứng với nước vì có lớp màng oxit Al2O3 bảo vệ
- Nếu phá vỡ lớp màng oxit thi Al phản ứng
2Al + 6H2O → 2Al(OH)3 + 3H2
- Phản ứng dừng lại do Al(OH)3 không tan sinh ra => nên thực tế vật bằng nhôm không tác dụng với nước .
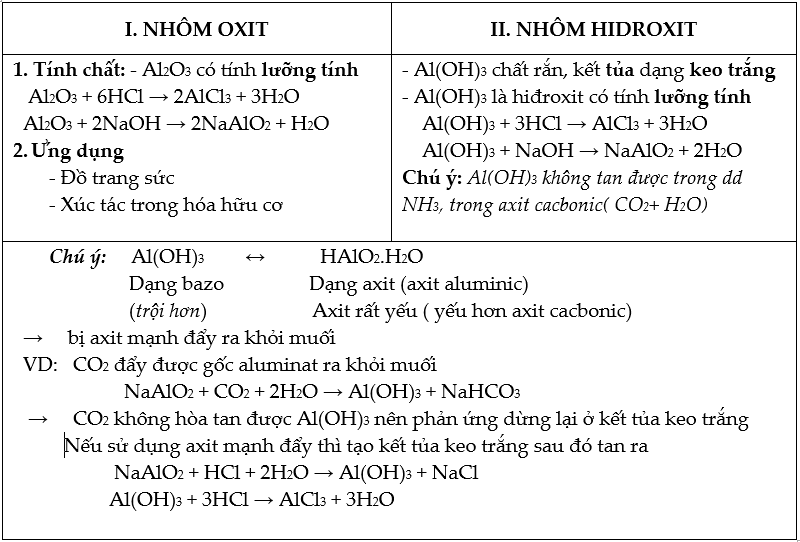
5. Tác dụng với dung dịch kiềm: Al tan được trong dung dịch kiềm là do
- Al2O3 bảo vệ tan ra ( do có tính lưỡng tính)
- Al phản ứng với nước :
2Al + 6H2O → 2Al(OH)3 + 3H2
- Al(OH)3 tan trong dd kiềm ( do có tính lưỡng tính): Al(OH)3 + NaOH → NaAlO2 + 2H2O
Phương trình tổng hợp:
Al + NaOH + H2O → NaAlO2 +H2
III. TRẠNG THÁI TỰ NHIÊN – SẢN XUẤT
1. Tự nhiên: - Nhôm là nguyên tố đứng thứ 3 (sau oxi, silic) và là kim loại phổ biến nhất trong vỏ Trái Đất
- Có trong: đất sét (Al2O3.2SiO2.2H2O), mica (K2O.Al2O3.6SiO2), boxit (Al2O3.2H2O), Criolit (3NaF.AlF3)
2. Điều chế: nguyên liệu : quặng boxit (Al2O3.2H2O)
Điện phân nóng chảy Al2O3 :
2Al2O3 → 4Al + 3O2
(Catot ) ( Anot)
Thêm criolit vào nhằm mục đích: + Hạ nhiệt độ nóng chảy ;tăng khả năng dẫn điện;bảo vệ Al khỏi bị oxi hóa bởi oxi trong không khí
Lưu ý: Không điều chế Al bằng cách điện phân AlCl3 vì AlCl3 là chất dễ bị thăng hoa
--------------------------------------------------
HỢP CHẤT CỦA NHÔM
III. NHÔM SUNFAT
- Công thức phèn chua: K2SO4.Al2(SO4)3.24H2O hay KAl(SO4)2.12H2O
Thay K+=Na+,Li+,NH4+ →phèn nhôm
- Ứng dụng: làm trong nước, sử dụng cho ngành da, nhuộm, giấy
- Hợp chất khác của nhôm:
Corindon: là dạng kết tinh của oxit nhôm với một ít tạp chất khác tạo nên các màu sắc khác nhau (rubi, saphia)
--------------------------------------------------
SẮT
I. VỊ TRÍ – CẤU TẠO – TRẠNG THÁI TỰ NHIÊN
1. Vị trí – cấu tạo : Số thứ tự: 26, chu kỳ 4, nhóm VIIIB
|
Cấu hình electron : 1s22s22p63s23p63d64s2 hoặc [Ar]3d64s2 |
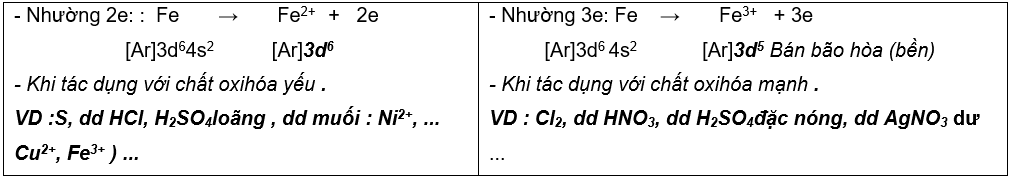
2. Trạng thái tự nhiên
II. HÓA TÍNH
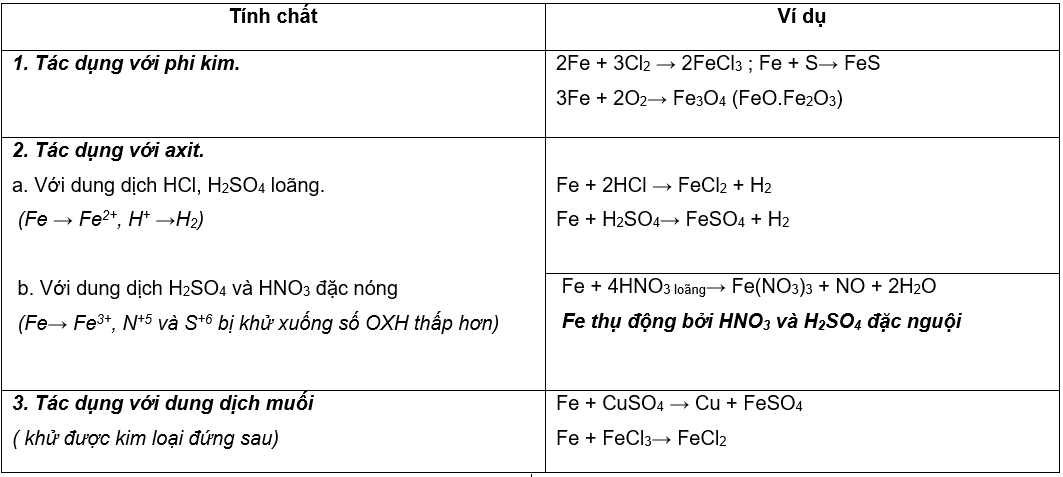
--------------------------------------------------
HỢP CHẤT CỦA SẮT
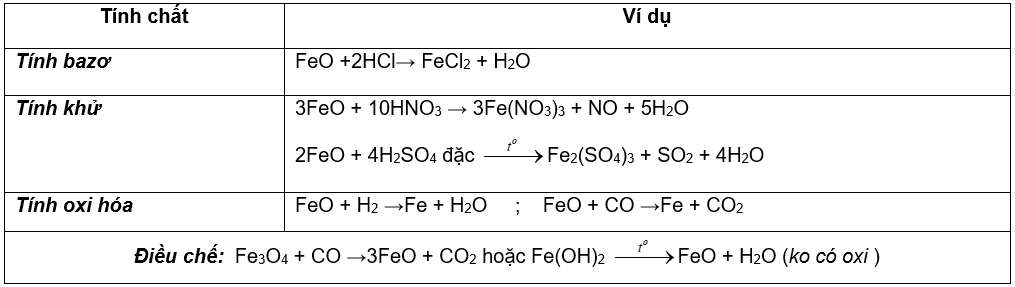
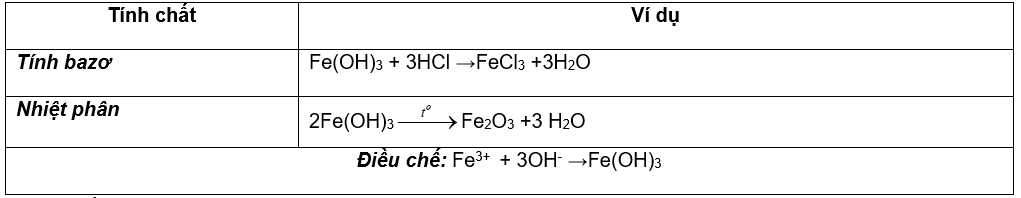
I.HỢP CHẤT SẮT (II): Tính chất hóa học đặc trưng là
tính khử: Fe2+ → Fe3+ + 1e và tính oxi hóa : Fe2+ + 2e → Fe
1. Hợp chất sắt (II) oxit:FeO ( màu đen )
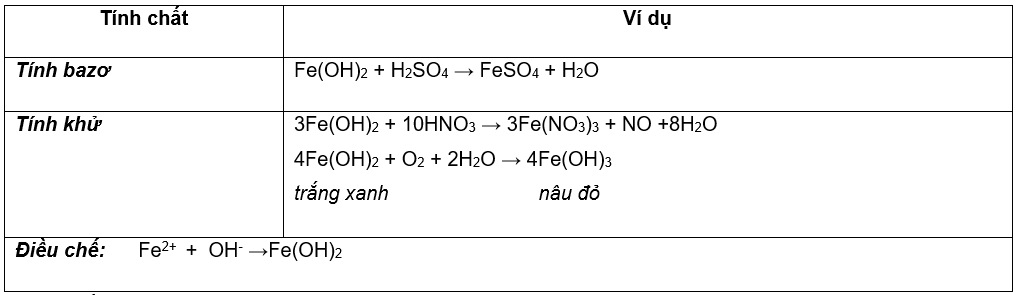
2. Hợp chất sắt (II) hidroxit:
Fe(OH)2 chất rắn, màu trắng xanh, hóa nâu ngoài không khí
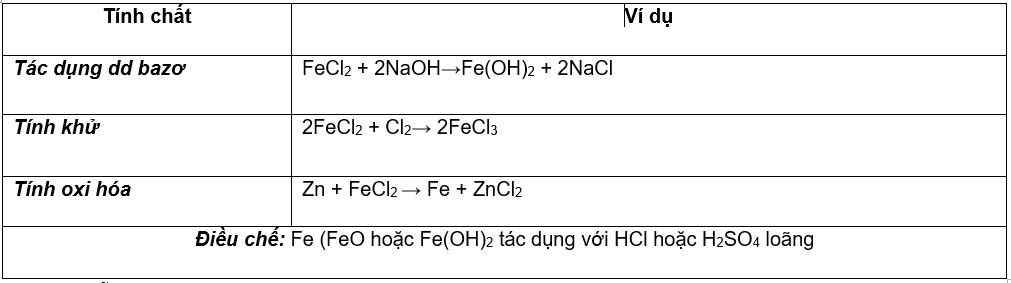
3. Muối sắt (II)
Chú ý: Fe3O4 là hỗn hợp của FeO.Fe2O3 = tính chất của FeO + Fe2O3
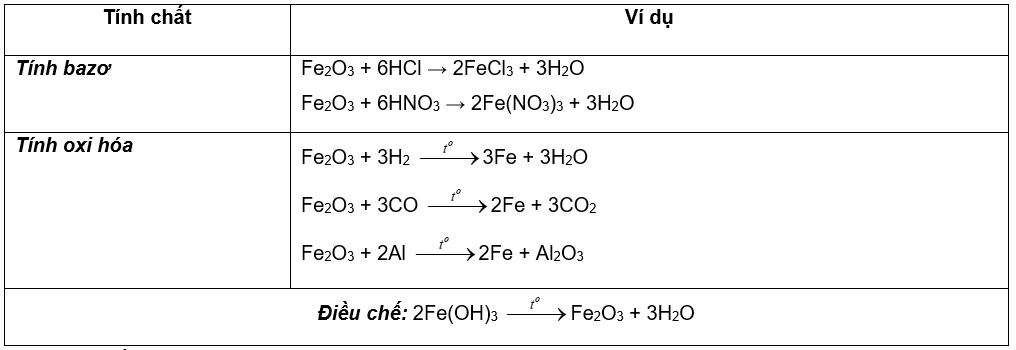
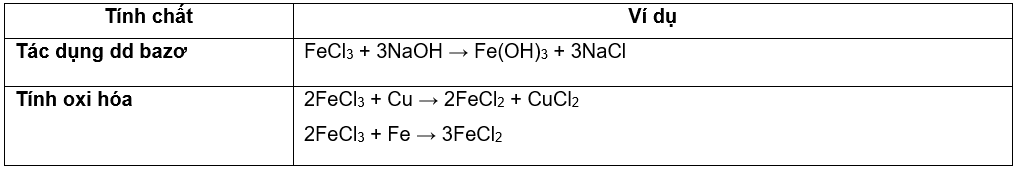
II. HỢP CHẤT SẮT (III)
Tính chất hóa học đặc trưng là tính oxi hóa:
Fe3+ + 1e→ Fe2+ hoặc Fe3+ + 3e → Fe
1.Hợp chất sắt (III) oxit: Fe2O3 ( màu đỏ nâu )
2.Hợp chất sắt (III) hidroxit: Fe(OH)3 chất rắn màu nâu đỏ
3. Muối sắt (III) : dd có màu vàng
--------------------------------------------------
HỢP KIM CỦA SẮT
--------------------------------------------------
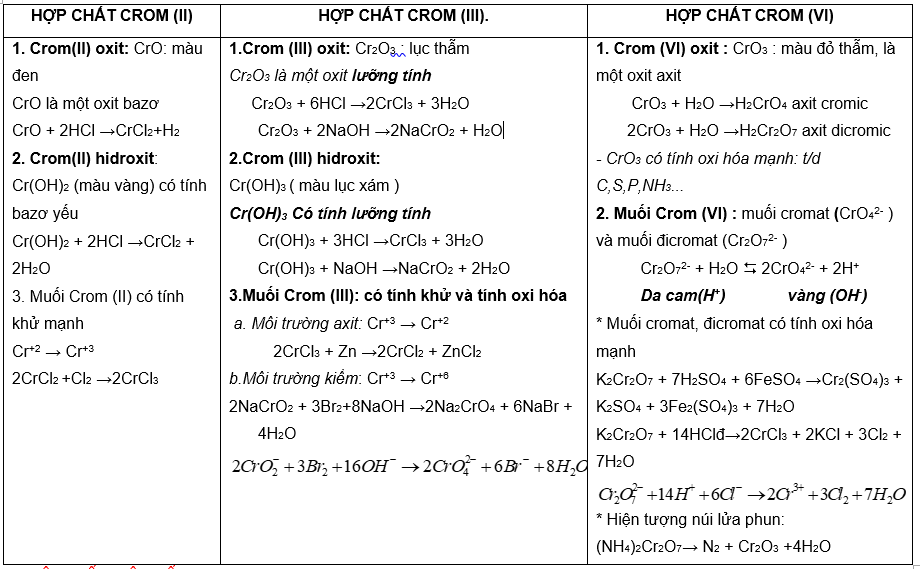
CROM
I. VỊ TRÍ – CẤU TẠO Cr: Z = 24, chu kỳ 4, nhóm VIB
- Cấu hình e: [Ar]3d54s1 (1e ở 4s chuyển sang 3d→ cấu hình bán bão hòa bền hơn)
II. HÓA TÍNH:
Tính khử Cr mạnh hơn Fe , yếu hơn kẽm (Cr có số oxi hóa +1 đến +6, thường gặp +2, +3, +6)
--------------------------------------------------
HỢP CHẤT CỦA CROM
--------------------------------------------------
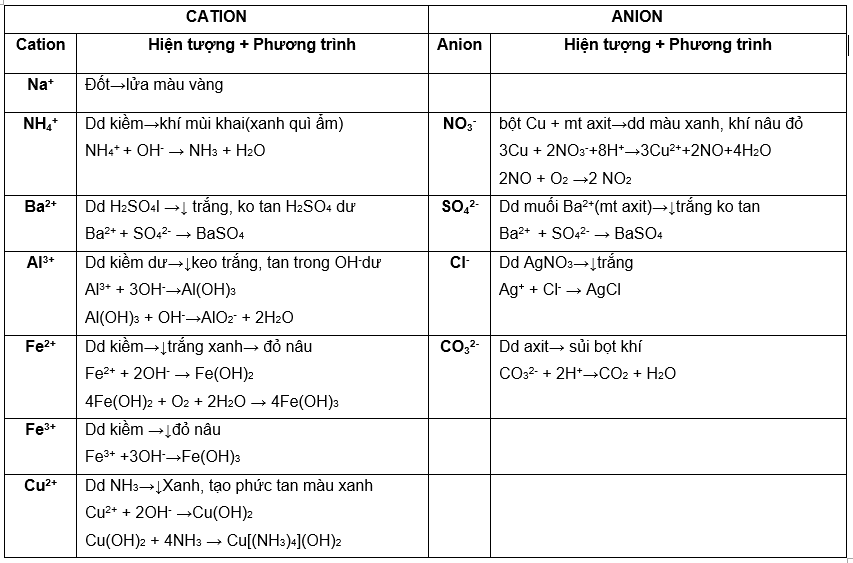
NHẬN BIẾT MỘT SỐ ION TRONG DUNG DỊCH
I. NHẬN BIẾT DUNG DỊCH
II. NHẬN BIẾT CHẤT KHÍ
--------------------------------------------------
HÓA HỌC VÀ VẤN ĐỀ PHÁT TRIỂN KINH TẾ
1. Một số chất gây nghiện: Rượu, thuốc phiện, cần sa, nicotin, cafein, cocain, heroin, mocphin,...
2. Các khí gây ô nhiễm: CO, CO2, SO2, H2S, NOx, CFC, bụi
Tác hại:
- Hiệu ứng nhà kính
- Sức khỏe
- Sinh trưởng, phát triển động, thực vật
- Phá tầng ozon, mưa axit ( do SO2 ; NO2 ,...)
3. Ô nhiễm môi trường nước
Nguyên nhân:
- Tự nhiên: mưa, gió bão lụt →kéo chất bẩn
- Nhân tạo: sinh hoạt, giao thông vận tải, thuốc trừ sâu
Các tác nhân gây ô nhiễm: ion kim loại nặng(Hg, Pb, Cu, Mn,...), anion NO3-, PO43-, SO42-, thuốc,...
Tác hại: lớn sự sinh trưởng, phát triển động thực vật
soanvan.me